MARIE CURIE
 Marie Curie, o meglio Marya
Sklodowska, nacque a Varsavia il 7 novembre 1867. In quel periodo la capitale
polacca era occupata dai Russi, che stavano cercando di indebolire l’èlite locale,
e si andava diffondendo la teoria del positivismo sostenuta da Auguste Comte e
basata sul valore dell’esperienza scientifica applicato alla società; questa
filosofia doveva lasciare una traccia indelebile sul carattere di Marya. Nata
in una famiglia di insegnanti e cresciuta in un ambiente caratterizzato da una
forte mancanza di fondi economici, cui poteva supplire solo un grande senso del
dovere, condusse la più spartana delle vite. Studiò fino alla fine del Liceo
nelle scuole del luogo e ricevette qualche nozione di tipo scientifico da suo
padre. In seguito ella partecipò attivamente ad un’organizzazione
rivoluzionaria studentesca e credette fosse prudente lasciare Varsavia, poiché
la città si trovava in quella parte della Polonia dominata dai Russi e si recò
a Cracovia, che a quel tempo faceva parte dei domini dell’impero
austro-ungarico.
Marie Curie, o meglio Marya
Sklodowska, nacque a Varsavia il 7 novembre 1867. In quel periodo la capitale
polacca era occupata dai Russi, che stavano cercando di indebolire l’èlite locale,
e si andava diffondendo la teoria del positivismo sostenuta da Auguste Comte e
basata sul valore dell’esperienza scientifica applicato alla società; questa
filosofia doveva lasciare una traccia indelebile sul carattere di Marya. Nata
in una famiglia di insegnanti e cresciuta in un ambiente caratterizzato da una
forte mancanza di fondi economici, cui poteva supplire solo un grande senso del
dovere, condusse la più spartana delle vite. Studiò fino alla fine del Liceo
nelle scuole del luogo e ricevette qualche nozione di tipo scientifico da suo
padre. In seguito ella partecipò attivamente ad un’organizzazione
rivoluzionaria studentesca e credette fosse prudente lasciare Varsavia, poiché
la città si trovava in quella parte della Polonia dominata dai Russi e si recò
a Cracovia, che a quel tempo faceva parte dei domini dell’impero
austro-ungarico.
Allieva brillante e matura,
dotata di una forte concentrazione, Maria coltivava il sogno di una carriera
scientifica, un sogno inconcepibile per una donna a quel tempo. Ma la mancanza
di fondi monetari fecero sì che dovesse limitarsi a divenire un’istitutrice.
Fece sacrifici enormi affinché sua sorella Bronia potesse conseguire la tanto
sognata laurea in Medicina alla Sorbona; secondo il patto stipulato dalle due sorelle,
inizialmente Marya avrebbe spedito tutto il proprio stipendio di istitutrice a
Bronia; una volta che questa si fosse laureata ed avesse trovato un lavoro,
avrebbe dovuto a sua volta sostenere la sorella minore negli studi.
E così, nel 1891, la timida
Marya arrivò a Parigi; ambiziosa ed introversa, aveva una grande ossessione:
imparare. Si laureò in Fisica con ottimi voti e continuò a frequentare un corso
di Matematica. Fu allora che un amico polacco le presentò il giovane Pierre
Curie. Nel 1895, questo libero pensatore, noto per un suo lavoro sulla
cristallografia e sul magnetismo, divenne suo marito. Un anno prima le aveva
scritto quanto sarebbe stato piacevole “trascorrere la vita l’uno
accanto all’altra, tesi alla realizzazione dei nostri sogni: il vostro sogno
patriottico, il nostro sogno umanitario ed il nostro sogno scientifico”.
All’inizio del 1896 Henri
Becquerel , specializzato in fluorescenza, (l’emissione di raggi luminosi da
parte di certi corpi dopo la loro esposizione alla luce), decise di procedere
ad un esperimento; volle vedere se quel fenomeno non fosse accompagnato dalla
produzione di nuovi raggi scoperti da Rontgen. Infatti, durante la sua
applicazione, le pareti del tubo dei raggi x divennero fluorescenti. Allora,
avvolse delle lastre fotografiche in un tessuto nero, le ricoprì di un foglio
di alluminio e pose su questo foglio dei cristalli di solfato di uranile e di
potassio, precedentemente esposti al sole. Dopo lo sviluppo, constatò che le
lastre erano offuscate: si verificava, dunque, un’emissione di “radiazione
penetrante”.
Quale oggetto migliore
poteva esserci per Marie che provare a comprendere l’effetto sviluppato
dall’energia di questi raggi? Anche Pierre se ne interessò subito. E così,
insieme alla moglie, maneggiando tonnellate di minerali, notò che un’altra
sostanza, il torio, era “radioattiva”, un termine coniato dalla stessa Marie.
Insieme, dimostrarono con
un’importante scoperta che la radioattività non era il risultato d'una  reazione chimica ma di una
proprietà dell' elemento o, più specificamente, dell' atomo. Marie allora
studiò la pechblenda, cioè l’uranio allo stato di minerale, in cui misurò
un'attività molto più intensa di quella presente nell’uranio da solo. Così
dedusse che esistevano altre sostanze molto radioattive oltre all’uranio, quali
il polonio, chiamato così in onore
della patria di Marie ed il radio, scoperto nel 1898. Essi riscontrarono che
l’uranio allo stadio di minerale, detto anche pechblenda, conteneva un livello
di radioattività superiore a quello che poteva essere attribuito alla sola
presenza dell’uranio.
reazione chimica ma di una
proprietà dell' elemento o, più specificamente, dell' atomo. Marie allora
studiò la pechblenda, cioè l’uranio allo stato di minerale, in cui misurò
un'attività molto più intensa di quella presente nell’uranio da solo. Così
dedusse che esistevano altre sostanze molto radioattive oltre all’uranio, quali
il polonio, chiamato così in onore
della patria di Marie ed il radio, scoperto nel 1898. Essi riscontrarono che
l’uranio allo stadio di minerale, detto anche pechblenda, conteneva un livello
di radioattività superiore a quello che poteva essere attribuito alla sola
presenza dell’uranio.
Analizzando l'intensità della
radiazione emessa per mezzo di una camera di ionizzazione, essi riconobbero che
i minerali dell'uranio, in modo particolare la pechblenda, avevano un'attività
radioattiva maggiore rispetto ai sali usati da Becquerel. Poiché non esistevano
elementi noti sufficientemente radioattivi da giustificare le radiazioni
osservate, essi dedussero che i minerali analizzati fossero composti da
sostanze ignote estremamente instabili.
La radioattività del torio
venne osservata successivamente dalla stessa Marie Curie, mentre quelle di
attinio e radon vennero scoperte nel 1899 rispettivamente dal chimico francese
André Louis Debierne e dai fisici inglesi Ernest Rutherford e Frederick Soddy.
Nei loro esperimenti, Pierre
osservò le proprietà della radiazione mentre Marie purificò gli elementi
radioattivi. Entrambi condividevano la stessa tenacia, tanto più ammirevole
date le loro circostanze di vita deplorevoli. Il loro laboratorio era niente
più che un misero capannone, in cui durante l’inverno la temperatura scendeva
ad intorno sei gradi, per cui le ricerche erano spesso eseguite in condizioni
difficili, con poco materiale a disposizione; inoltre entrambi erano sfibrati
dalle molte ore di insegnamento che erano loro necessarie per poter raggiungere
uno stipendio ancorché minimo che consentisse loro di sopravvivere. Malgrado la
loro difficoltà nell’ottenere dei prestiti, i coniugi Curie rifiutarono di
registrare a loro nome un brevetto che li avrebbe assicurati finanziariamente;
ai loro occhi, il permettere a tutti gli scienziati, francesi o stranieri che
fossero, di conoscere la teoria della radioattività aveva la priorità sulle
questioni di interesse economico.
Pierre esaminò
gli effetti che il radio produceva sulla sua pelle. Esso gli causò un'ustione
che poi divenne una ferita: fu così che vennero dimostrati gli effetti del
radio sull' uomo. Presto il radio cominciò ad essere utilizzato per curare i
tumori maligni: venne introdotta la terapia Curie.
Marie ricevette, sempre con suo marito,
la medaglia Davy da parte della Royal Society nel 1903, e nel 1921 il
presidente degli Stati Uniti d’America, Harding, su richiesta delle donne
americane, le donò un grammo di Radio quale riconoscimento del servizio da lei
reso alla scienza.
I Curie vinsero il premio
Nobel del 1903 per la Fisica, grazie alla loro scoperta. Essi divisero il
riconoscimento con un altro fisico francese, Antoine Henri Becquerel, che aveva
scoperto la radioattività naturale. Madame Curie continuò il suo lavoro sugli
elementi radioattivi e vinse un secondo premio Nobel nel 1911, questa volta per
la Chimica.
La felicità dei
coniugi Curie fu breve. Nel 1906, Pierre, indebolito dalle radiazioni e
sovraccarico di lavoro, venne investito da un carro. Marie fu costretta a
continuare da sola. S’incaricò dell’istruzione delle sue due figlie; successe a
suo marito come direttrice del laboratorio di Fisica alla Sorbona e dopo la
tragica morte di Pierre, ella prese il suo posto come Professore di Fisica
Generale della Facoltà di Scienze, prima donna ad assumere tale ruolo. Sviluppò
inoltre metodi per la separazione del radio da residui di natura radioattiva,
in quantità sufficiente da permettere uno studio attento delle sue proprietà,
soprattutto di quelle terapeutiche. Marie Curie, donna silenziosa, piena di
dignità ma non superba, era tenuta in grande stima ed ammirazione dagli
scienziati di tutto il mondo.
Dal 1911 divenne membro del
Conseil du Physique Solvay, mantenne questa carica fino alla morte e dal 1922
entrò a far parte del Comitato a favore della cooperazione intellettuale tra le
Nazioni. Il suo lavoro è ricordato in numerose pagine di varie pubblicazioni
scientifiche ed ella è l’autrice di “Recherches sur les Substances
Radioactives”
(1904), “L'Isotopie et les Éléments Isotopes” e l’ormai classico “Traité' de Radioactivité” (1910). L’importanza del lavoro di Madame
Curie è evidente anche dai numerosi premi che ella ricevette, come anche dalle
lauree onorarie in Medicina ed in Legge che le furono conferite.
Anche lei
dovette combattere i pregiudizi della sua epoca: la xenofobia ed il sessismo che, nel 1911, le
impedirono di far parte dell’Accademia delle Scienze. Ma, subito dopo, fu
onorata dal premio Nobel per la Chimica, poiché ella aveva isolato il radio e
ne aveva studiato le proprietà chimiche, determinandone così il peso atomico.
In seguito anche sua figlia Irene venne insignita il Nobel per la Chimica,
assieme a suo marito, Frederic Joliot.
Ma le sue più
grande gioie, furono dovute alla fondazione dell' istituto del radio dell'
università di Parigi, di cui fu la prima direttrice e all'Istituto di
Pasteur che nel 1914 le permise di
compiere il suo sogno umanitario. Fu allora che scoppiò la guerra. Ella,
assieme alla figlia Irene, che fu sempre al suo fianco, credette che i raggi X
potessero aiutare i medici nell’individuare dei proiettili che avevano causato
ferite profonde e che erano rimasti all’interno del corpo del paziente,
facilitando le operazioni chirurgiche. Anche non spostare il ferito era molto
importante, così ella creò delle speciali automobili, munite delle
apparecchiature e del personale necessari affinché ovunque nelle zone di
combattimento si potessero raccogliere feriti e gli esami radiologici si potessero
effettuare immediatamente. Queste automobili furono subito soprannominate “le
piccole Curie”. Ella riuscì a convincere 150 donne a lavorare con lei. Poiché
l’unica protezione dai raggi X in uso a quel tempo era costituita da uno
schermo e da un paio di guanti, tutto ciò di cui aveva bisogno era di
convincere i medici reticenti e di educare delle manipolatrici.
L’entusiasmo che Marie
provava nei confronti della scienza non si affievolì mai ed ella si adoperò
personalmente affinché fosse fondato un laboratorio per lo studio della
radioattività nella sua città natale, Varsavia; fu a favore di questo
laboratorio che il presidente americano Hoover le consegnò la somma di 50000
dollari, donata dall’associazione degli American friends of science.
Subito dopo la
guerra, tornò a lavorare nel suo istituto con Irene al suo fianco. Marie
guidava il laboratorio di ricerca, mentre il Dottor Claudius Regaud faceva capo
al laboratorio di biologia applicata. La loro cooperazione si dimostrò
armoniosa, poiché i due avevano ideali molto simili e possedevano lo stesso
disinteresse nei confronti delle questioni economiche. Fisici e chimici
provvedevano ad isolare il radio, ed i medici lo somministravano ai loro
pazienti. Marie si adoperò per trovare fondi e materiale, recandosi anche negli
Stati Uniti; ma trovava duro da accettare che fossero gli interessi economici a
prevalere.
Marie morì a Savoy, in
Francia, di leucemia, il 4 Luglio del 1934, esausta e quasi cieca, con le dita
bruciate dal “suo” caro radio. Questa donna di sessantasette anni, che, secondo
il Dottor Claudius Regard “sotto un’apparenza fredda e riservata
(…) nascondeva in realtà
un’abbondanza di sentimenti delicati e generosi”, era stata esposta ad
un’incredibile quantità di radiazioni. Altri ricercatori dopo di lei, tra cui
sua figlia avrebbero pagato lo stesso prezzo. In gennaio, assieme a suo marito
Frédéric Joliot, Irene, che aveva lavorato nello stesso laboratorio di sua
madre e con la stessa determinazione, scoprì la radioattività artificiale; a
seguito di questa scoperta anch’ella fu insignita del premio Nobel.
La radioattività è il punto
di partenza per la cura del cancro, per stabilire la data a cui risalgono
rocce, oggetti antichi, lo stesso universo, come nello studio della biologia molecolare
e nella moderna scienza genetica; è anche la sorgente dell’energia nucleare e
della bomba atomica. L’altra faccia della medaglia….
A
poca distanza dal Pantheon si trova l’istituto chiamato Curie. La sua missione
è il promuovere la collaborazione fra le scienze e fra gli scienziati, avendo
come obiettivo ultimo la prevenzione, la diagnosi ed il trattamento del cancro.
Non meno di 400 persone lavorano alla ricerca e novecento alla divisione
medica. Il lavoro di ricerca si focalizza sulle aree principali dello studio
della biologia molecolare e cellulare dei tumori, dei geni, e dei meccanismi
che sviluppano l’immunità, inoltre sulla sintesi e lo sviluppo di nuove
molecole.
Radioterapia
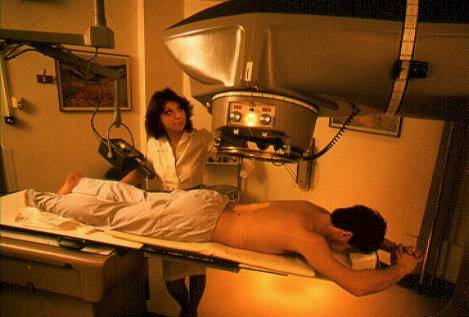
Un paziente si sottopone a un'applicazione di radioterapia per la
cura di un cancro spinale. Questo tipo di trattamento consiste nella
distruzione dei tessuti cancerosi per mezzo di raggi gamma emessi da una
sorgente di cobalto 60 e indirizzati nel punto esatto da un apposito
dispositivo laser.
Il Claudius Regaud Hospital,
con il suo dipartimento di radioterapia ben equipaggiato, ha una grande
efficienza. Ogni anno, l’ospedale fornisce 70,000 consultazioni e 6,000
pazienti ricevono qui delle cure; vi è anche un ostello dove possono stabilirsi
i genitori dei bambini ricoverati.
Ad Orsay, alla periferia di Parigi, anche
l’Istituto Curie offre un centro di terapie usato per curare con le radiazioni,
quei tumori non facilmente raggiungibili con delle operazioni chirurgiche, e
tentando di preservare la salute generale dei pazienti. Infine, nell’Istituto
vengono anche condotti dei test sulla terapia genica.
RADIOATTIVITA’
Disintegrazione spontanea di
nuclei atomici, con emissione di particelle subatomiche e di onde elettromagnetiche.
Il fenomeno fu scoperto nel 1896 dal fisico francese Antoine-Henri Becquerel,
il quale osservò che l'uranio emetteva delle radiazioni capaci di impressionare
una lastra fotografica, benchè protetta da uno schermo opaco ai raggi luminosi.
Le ricerche iniziate da
Becquerel vennero riprese dai Curie, i quali scoprirono che la proprietà di
emettere radiazioni penetranti era una proprietà dell'atomo e non dipendeva
dallo stato chimico o fisico dell'elemento, e diedero al fenomeno il nome di radioattività.
Si comprese subito che la
radioattività era la sorgente di energia più concentrata fino ad allora mai
osservata. I Curie misurarono il calore associato al decadimento del radio, e
stabilirono che 1 g di radio produce circa 420 J di energia all'ora, e che tale
effetto prosegue incessantemente.
Si ricordi, per confronto, che la combustione di 1 g di
carbone produce un totale di 33.600 J di energia. A seguito di questi
risultati, la radioattività attirò l'attenzione degli scienziati di tutto il mondo
e nei decenni successivi molti aspetti del fenomeno vennero studiati
ampiamente.
TIPI DI RADIAZIONI
Ernest
Rutherford scoprì che vi sono almeno due componenti nelle emissioni radioattive:
le particelle alfa, che penetrano solo per alcuni millesimi di centimetro
nell'alluminio, e le particelle beta, caratterizzate da un potere penetrante
100 volte maggiore. Esperimenti successivi, nei quali la radiazione fu
sottoposta a campi elettrici e magnetici, rivelarono la presenza di una terza
componente ad alta energia, i raggi gamma. In un campo elettrico le particelle
beta vengono fortemente deflesse verso il polo positivo, quelle alfa sono
deflesse in misura minore verso il polo negativo, mentre la traiettoria dei
raggi gamma non risente dell'effetto del campo. Ne deriva che le particelle
beta sono dotate di carica negativa, le particelle alfa trasportano cariche
positive (e hanno massa maggiore delle particelle beta) e i raggi gamma sono
elettricamente neutri.
La scoperta che il radio
decade producendo radon fu la prova conclusiva che il decadimento radioattivo è
accompagnato da una trasformazione chimica dell'elemento instabile. In seguito
si dimostrò che le particelle beta sono elettroni e che i raggi gamma sono
radiazioni elettromagnetiche ad alta energia.
L'IPOTESI NUCLEARE
La scoperta della radioattività segnò l'inizio di una serie di
sistematiche ricerche sulla natura dei costituenti della materia.
Evoluzione del modello atomico
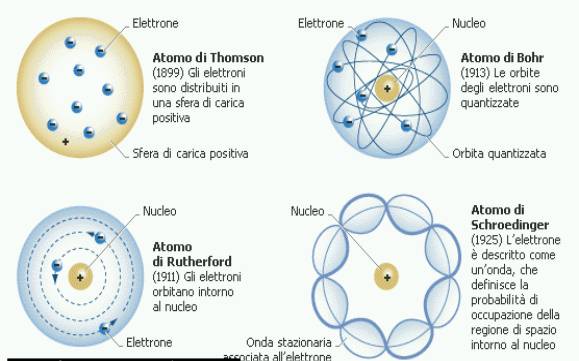 Il
modello atomico attuale è il risultato di successivi miglioramenti ottenuti dai
fisici grazie alla disponibilità di dati sperimentali sempre più accurati. Il
modello di Thompson prevedeva che gli elettroni fossero distribuiti in una
sfera di carica positiva. Rutherford fu il primo a comprendere che la carica
positiva era invece concentrata al centro dell'atomo (nucleo), mentre riteneva
che gli elettroni orbitassero nello spazio ad essa circostante. Bohr andò
oltre, introducendo il concetto di quantizzazione delle orbite elettroniche.
Schrödinger infine rivoluzionò l'idea di orbita elettronica intendendola non
più come la traiettoria fisicamente percorsa dall'elettrone, ma come regione di
spazio che possiede la più alta probabilità di essere occupata dall'elettrone.
Il
modello atomico attuale è il risultato di successivi miglioramenti ottenuti dai
fisici grazie alla disponibilità di dati sperimentali sempre più accurati. Il
modello di Thompson prevedeva che gli elettroni fossero distribuiti in una
sfera di carica positiva. Rutherford fu il primo a comprendere che la carica
positiva era invece concentrata al centro dell'atomo (nucleo), mentre riteneva
che gli elettroni orbitassero nello spazio ad essa circostante. Bohr andò
oltre, introducendo il concetto di quantizzazione delle orbite elettroniche.
Schrödinger infine rivoluzionò l'idea di orbita elettronica intendendola non
più come la traiettoria fisicamente percorsa dall'elettrone, ma come regione di
spazio che possiede la più alta probabilità di essere occupata dall'elettrone.
Nel 1911, a seguito degli
esperimenti di diffusione di particelle alfa da parte di lamine metalliche,
Rutherford ipotizzò che l'atomo fosse composto da un nucleo centrale nel quale
era concentrata la maggior parte della massa, mentre gli elettroni orbitavano
intorno al nucleo stesso, coprendo una regione di spazio circa 10.000 volte
maggiore, che perciò risultava pressochè vuota.
Da allora, l'ipotesi nucleare
si è sviluppata in una teoria complessa della struttura atomica, che spiega in
modo soddisfacente l'intero fenomeno della radioattività. Si è trovato che
l'atomo è costituito da un denso nucleo centrale, circondato da una nuvola di
elettroni; a sua volta il nucleo è composto da protoni, di numero pari a quello
degli elettroni (per bilanciarne la carica negativa), e da neutroni, che sono
particelle neutre aventi approssimativamente la stessa massa dei protoni.
Una particella alfa è composta da due neutroni e due protoni e
pertanto può essere emessa solo dal nucleo di un atomo.
Particelle alfa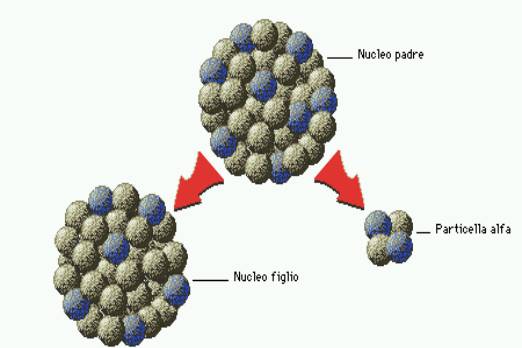
Una particella alfa è costituita da due protoni e due neutroni,
esattamente come un nucleo di elio. Viene emessa in un processo radioattivo,
detto decadimento alfa, da nuclei atomici instabili relativamente pesanti. In
seguito al decadimento, questi ultimi cambiano natura chimica riducendo il proprio numero
atomico di due unità.
Quando un nucleo decade
perdendo una particella alfa, si forma un nuovo nucleo, più leggero del precedente.
Un isotopo dell'uranio con numero di massa 238, ad esempio, si trasforma
nell'atomo dell'elemento con numero di massa 234, avente due protoni e due
neutroni in meno, ovvero in un isotopo del torio. Il torio 234 è a sua volta un
elemento instabile e decade con emissione di particelle beta. L'emissione è
dovuta alla trasformazione di un neutrone in un protone, per cui comporta un
aumento della carica nucleare (o equivalentemente numero atomico) di un'unità.
Poiché la massa
dell'elettrone è trascurabile rispetto a quella dei nucleoni, l'isotopo che
proviene dal decadimento del torio 234 ha numero di massa 234 e numero atomico
91 ed è pertanto un isotopo del protattinio.
RADIAZIONE ALFA, BETA E
GAMMA
Decadimento beta
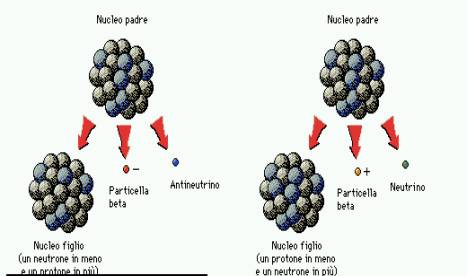
Il decadimento beta può avvenire in due forme distinte. A
sinistra è rappresentato il decadimento beta meno: un neutrone si
trasforma in un protone, un elettrone (particella beta meno) e un antineutrino.
Nel decadimento beta più (a destra), un protone decade in un neutrone,
un positrone (particella beta più) e un neutrino. Dunque, un nucleo che decade
beta acquista o perde un protone, trasformandosi in un elemento adiacente della
tavola periodica.
Nei decadimenti alfa e beta
vengono di solito emessi quasi simultaneamente anche raggi gamma. Questi ultimi
non posseggono né carica né massa, quindi la loro emissione non causa un
cambiamento delle proprietà chimiche dell'atomo, ma solo la perdita di una
determinata quantità di energia sotto forma di radiazione.
L'emissione di raggi gamma è
una compensazione da parte del nucleo allo stato instabile in cui si viene a
trovare a seguito dell'emissione di particelle alfa e beta.
Alcuni isotopi decadono con
pura emissione gamma. Questa situazione si verifica quando un isotopo esiste in
due diverse forme, chiamate isomeri nucleari, che hanno numero atomico e numero
di massa identici, ma differente energia. L'emissione di raggi gamma accompagna
la transizione dell'isomero di alta energia a quello di energia minore. L'isotopo
protattinio 234, ad esempio, esiste in due distinti stati energetici, e
l'emissione di raggi gamma segnala la transizione da uno stato all'altro.
La velocità delle particelle alfa e beta emesse durante un
decadimento è estremamente alta. In particolare, a ciascun isotopo di un
elemento chimico corrisponde una determinata velocità delle particelle emesse:
così, le particelle alfa prodotte dal decadimento del polonio 210 compiono
nell'aria un percorso di circa 4 cm prima di arrestarsi, mentre quelle del
polonio 212, nelle medesime condizioni, viaggiano per 8,5 cm. La misurazione
della distanza percorsa dalle particelle alfa permette dunque di identificare
gli isotopi emittenti.
Isotopi
dell'idrogeno
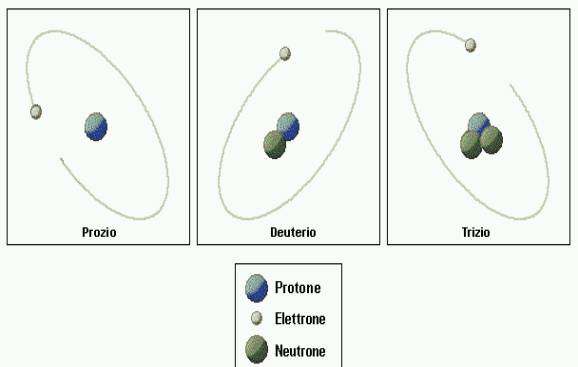 Gli
isotopi sono atomi di uno stesso elemento aventi un ugual numero di protoni ma
un diverso numero di neutroni. La forma isotopica più abbondante dell'idrogeno
(prozio) è costituita da un solo protone intorno al quale orbita un unico
elettrone. Ne esistono però altre due: il deuterio, che ha un neutrone nel
nucleo, e il trizio, che ne ha due.
Gli
isotopi sono atomi di uno stesso elemento aventi un ugual numero di protoni ma
un diverso numero di neutroni. La forma isotopica più abbondante dell'idrogeno
(prozio) è costituita da un solo protone intorno al quale orbita un unico
elettrone. Ne esistono però altre due: il deuterio, che ha un neutrone nel
nucleo, e il trizio, che ne ha due.
Le particelle beta vengono
espulse a velocità molto elevate e quindi percorrono nella materia distanze
maggiori, anche se il meccanismo che ne determina l'arresto è sostanzialmente
simile.
La distribuzione delle energie delle particelle beta ha reso
necessaria l'ipotesi dell'esistenza di una particella neutra e priva di massa
chiamata neutrino, che accompagna ogni decadimento beta.
I raggi gamma sono dotati di
un elevato potere penetrante, e in alcuni casi possono attraversare parecchi
centimetri di piombo prima di subire un sensibile rallentamento.
La radiazione alfa, beta e
gamma interagisce profondamente con la materia, provocando un’intensa
ionizzazione. Questo fenomeno, estremamente accentuato per le particelle alfa,
meno per le beta e ancora meno per le gamma (essendo radiazione neutra, non
riesce a indurre facilmente la ionizzazione), è particolarmente evidente nei
gas. Sull'effetto ionizzante della radiazione si basa il principio di funzionamento
di molti strumenti, come il contatore di Geiger-Müller e altre camere a
ionizzazione, che vengono usati per misurare le intensità delle singole
radiazioni e le velocità di decadimento delle sostanze radioattive.
La velocità di
disintegrazione di un elemento instabile viene misurata in Curie, dove Curie è
uguale al numero di disintegrazioni primarie cui dà luogo un grammo di radio
nell'intervallo di tempo di un secondo. Il valore è stato determinato
sperimentalmente: il risultato, pari a 3,71 × 1010, è stato arrotondato a 3,7 × 1010 e reso indipendente da ogni successiva misura.
TEMPO DI
DIMEZZAMENTO
Decadimento del bosone Z0 (vista longitudinale)
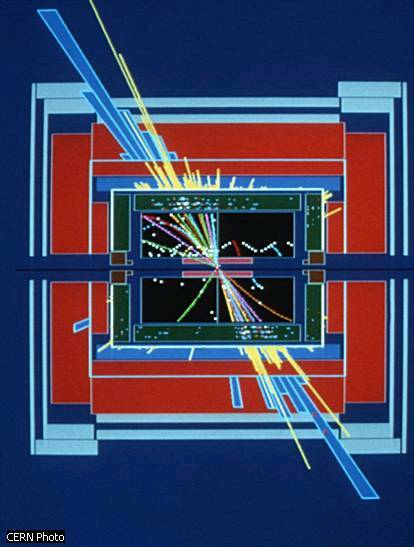
Un evento di decadimento di un bosone Z0 in molte particelle, attraverso una coppia quark-antiquark.
L'evento è ottenuto dall'esperimento ALEPH, uno dei quattro che stanno
raccogliendo dati al collisore leptonico LEP del CERN dal 1989. L'evento è
visto in una sezione longitudinale dell'apparto rivelatore. Dalla sua messa in
funzione, il LEP ha prodotto molti milioni di Z0,
permettendo ai fisici di misurarne la massa con estrema precisione. I risultati
dei quattro esperimenti combinati hanno fornito come risultato 91,1884 GeV, con
un errore del 2,2 per mille.
Il decadimento di alcune sostanze,
come l'uranio 238 e il torio 232, sembra continuare indefinitamente senza una
sensibile diminuzione del numero di disintegrazioni al secondo. Altre sostanze
radioattive mostrano invece una decisa riduzione dell'attività di decadimento
col passare del tempo; tra queste vi è l'isotopo torio 234 (originariamente
chiamato uranio X), la cui velocità di disintegrazione si dimezza in 25 giorni.
Questo intervallo di tempo, caratteristico di ogni specie radioattiva, viene
detto "tempo di dimezzamento" ed esprime il tempo nel quale (in
media) una determinata quantità di un elemento instabile si riduce a metà del
valore originario. Il tempo di dimezzamento può essere talmente lungo da non
essere misurabile con precisione con i metodi disponibili: il torio 232, ad
esempio, ha un periodo di semitrasformazione di circa 14 miliardi di anni.
Spesso, anzichè il tempo di dimezzamento, si indica la "vita media"
di un elemento, che equivale al periodo di tempo necessario affinchè il numero
di atomi si riduca a circa il 37% del suo valore iniziale (Emivita).
SERIE RADIOATTIVE
Quando l'uranio 238 decade,
emettendo una particella alfa, si forma il torio 234; questo a sua volta decade
con emissione di una particella beta formando il protoattinio 234. Il
protoattinio 234 emette una particella beta, e si trasforma in un nuovo isotopo
dell'uranio, con numero di massa 234. Quest'ultimo si disintegra con emissione
alfa per formare il torio 230, che a sua volta decade emettendo delle
particelle alfa e formando il radio 226.
Questa serie radioattiva,
chiamata serie dell'uranio, prosegue in modo analogo, e attraverso ulteriori
cinque emissioni alfa e quattro emissioni beta, arriva al prodotto finale, un
isotopo non radioattivo (stabile) del piombo, con numero atomico 82 e numero di
massa 206. Ogni elemento della tavola periodica situato fra l'uranio e il
piombo è rappresentato in questa serie, e ogni nuclide è caratterizzato dal suo
caratteristico tempo di dimezzamento.
I membri della serie hanno
tutti una caratteristica comune: i loro numeri di massa (divisibili esattamente
per quattro, una volta che sia stato loro sottratto il numero 2) possono essere
espressi dalla semplice formula 4n + 2, dove n è un numero
intero.
Altre serie naturali sono
quella del torio, detta serie 4n perché i numeri di massa di tutti i
suoi membri sono esattamente divisibili per 4, e quella dell'attinio, o serie 4n
+ 3. Il capostipite della serie del torio è l'isotopo torio 232 e il suo
elemento finale è l'isotopo stabile piombo 208.
La serie dell'attinio comincia
con l'uranio 235 (chiamato attinuranio dai primi ricercatori) e si conclude col
piombo 207.
DATAZIONI
Datazione
al radiocarbonio
Il metodo di datazione al radiocarbonio è applicabile unicamente ai
fossili di natura organica che abbiano un'età dell'ordine delle migliaia di
anni. Mentre in vita la quantità di carbonio viene mantenuta costante
attraverso la respirazione e l'alimentazione, dopo la morte la frazione di
isotopo radioattivo 14C inizia a decadere in 14N, dimezzandosi ogni
5730 anni circa. Convertendo il carbonio del fossile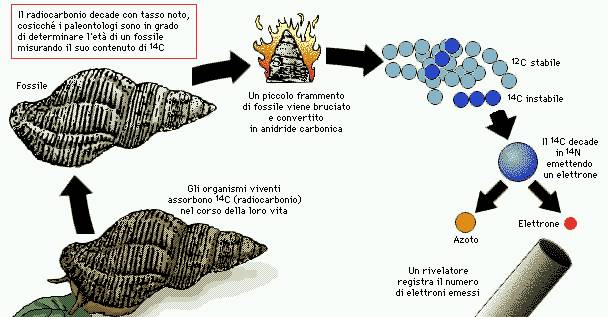 in anidride carbonica è possibile misurare con un contatore la
quantità di 14C. Mettendola in relazione a quella dell'isotopo stabile 12C,
noto il periodo di dimezzamento, si può risalire a una buona stima dell'età del
fossile.
in anidride carbonica è possibile misurare con un contatore la
quantità di 14C. Mettendola in relazione a quella dell'isotopo stabile 12C,
noto il periodo di dimezzamento, si può risalire a una buona stima dell'età del
fossile.
Il fenomeno della
radioattività naturale, ovvero del decadimento di specie atomiche instabili
esistenti in natura, permette di stabilire l'età del nostro pianeta. Un metodo
di datazione delle rocce si basa sul decadimento dell'uranio e del torio; il
processo di disintegrazione di questi due elementi è iniziato fin dalla
formazione dei loro minerali e ha prodotto particelle alfa che sono rimaste
intrappolate (come atomi di elio) all'interno delle rocce stesse. Determinando
accuratamente le quantità relative di elio, uranio e torio contenute in una
roccia è possibile calcolare da quanto tempo è in atto il processo di
decadimento, e quindi l'età della roccia.
Un altro metodo è basato
sulla determinazione dei rapporti tra le concentrazioni degli elementi iniziali
e finali delle serie radioattive; in particolare si misura il rapporto tra
uranio 238 e piombo 206 o tra torio 232 e piombo 208 presenti nella roccia.
Questi e altri metodi attribuiscono
alla Terra un età di circa 4,65 miliardi di anni, valore confermato sia
dall'analisi di meteoriti cadute sulla superficie terrestre, sia dai campioni
di rocce lunari prelevate dall'Apollo
11 –
durante l'allunaggio del luglio 1969 – che forniscono un età molto simile anche
per tutti gli altri pianeti del sistema solare.
APPLICAZIONI
Lo studio delle reazioni
nucleari e le ricerche sulla radioattività artificiale, specie fra gli elementi
pesanti, sono all'origine della scoperta della fissione nucleare e del
conseguente sviluppo della bomba atomica. Queste ricerche hanno però trovato
applicazioni anche nel settore scientifico, industriale e militare. Sono stati
scoperti elementi chimici che non esistono in natura e, grazie allo sviluppo
dei reattori nucleari, sono stati prodotti radioisotopi di quasi tutti gli
elementi della tavola periodica, utilizzati principalmente (come sorgente di
radiazione e come traccianti) nella ricerca chimica, biologica e medica.
Particolarmente importante
tra gli isotopi radioattivi artificiali è il carbonio 14, che ha periodo di
dimezzamento di 5730 ± 40 anni. La disponibilità di questa sostanza ha permesso
lo studio di numerosi aspetti dei processi biologici, ad esempio la
fotosintesi. Inoltre, una piccola quantità di carbonio 14 è presente
nell'atmosfera terrestre e tutti gli organismi viventi ne assorbono tracce
durante la loro vita. Dopo la morte, questo assorbimento cessa, e la
concentrazione del carbonio radioattivo diminuisce rispetto ai valori iniziali.
Stime dell'età dei reperti archeologici, come ossa e mummie, sono state
possibili mediante misurazioni della concentrazione del carbonio 14 in essi
contenuta.