SPETTROSCOPIA
Margherita Hack

Margherita Hack, fiorentina, si è laureata in fisica nel 1945 all’Università di Firenze. Socio nazionale dell’Accademia dei Lincei, è ordinario di astronomia dell’Università di Trieste, dopo averne diretto il Dipartimento di Astronomia dal 1985 al 1990. Dal 1964 al 1987 ha diretto l’Osservatorio astronomico di Trieste. Attualmente è direttore del centro interuniversitario regionale per l’astrofisica e la cosmologia. Scienziata di fama e prestigio mondiali, ha pubblicato numerosi saggi su riviste internazionali e una quindicina di libri, sia di livello universitario sia divulgativi.
Tra questi merita di essere ricordato “L’universo alle soglie del duemila”.
La sua tesi di laurea si occupava dello studio dello
spettro di una cefeide, e da allora il suo campo di ricerca ha riguardato
fondamentalmente la spettroscopia stellare.
SPETTROSCOPIA
In fisica e chimica fisica lo
studio degli spettri associati all'emissione o all'assorbimento di radiazione
elettromagnetica da parte di nuclei, atomi, molecole. La spettroscopia
costituisce un potente strumento di analisi chimica poiché ogni elemento
chimico, e in generale ogni sostanza, presenta uno spettro caratteristico che fornisce
informazioni dettagliate e precise sulla sua struttura o sulla sua composizione
GLI
STRUMENTI
Nel 1859 gli scienziati tedeschi
Gustav Robert Kirchhoff e Robert Wilhelm Bunsen identificarono il cesio e il
rubidio per mezzo di uno spettroscopio di loro costruzione, che utilizzava un
prisma come elemento dispersivo. Lo strumento, tuttora considerato uno dei due
tipi fondamentali di spettroscopio, si componeva di un collimatore, realizzato
mediante una fenditura e un gruppo di lenti, un prisma per la dispersione e un
cannocchiale, costituito da un obiettivo e un oculare. La luce da analizzare,
proveniente da una sorgente esterna, attraversa la fenditura e una o più lenti
di collimazione e viene quindi indirizzata sul prisma. Per effetto delle due
rifrazioni sulle superfici del prisma, il raggio viene separato in tutte le sue
componenti e dà luogo a una serie di immagini della fenditura, ciascuna di
colore diverso, che vengono messe a fuoco mediante l'oculare. Si deve a
Kirchoff e Bunsen aver riconosciuto che ciascun elemento chimico genera uno
spettro di colori caratteristici, che potrebbero essere definiti la sua
"impronta digitale".
Spettrometro ad assorbimento
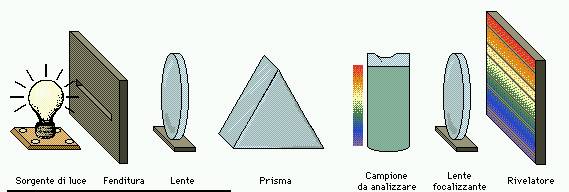 Lo
spettrometro è uno strumento che analizza e misura spettri di radiazione. Uno
spettrometro ad assorbimento permette di determinare la natura di una sostanza
ignota, mediante l’analisi della luce che la attraversa. Scissa da un prisma
nei colori fondamentali che la compongono e opportunamente focalizzata da un
sistema di lenti e fenditure, la luce che raggiunge lo schermo è composta dalle
lunghezze d’onda che non sono state assorbite dalla sostanza.
Lo
spettrometro è uno strumento che analizza e misura spettri di radiazione. Uno
spettrometro ad assorbimento permette di determinare la natura di una sostanza
ignota, mediante l’analisi della luce che la attraversa. Scissa da un prisma
nei colori fondamentali che la compongono e opportunamente focalizzata da un
sistema di lenti e fenditure, la luce che raggiunge lo schermo è composta dalle
lunghezze d’onda che non sono state assorbite dalla sostanza.
Spettrografo
In uno spettrografo, il
cannocchiale è sostituito da un dispositivo fotografico che fornisce la
fotografia dello spettro. Può essere utilizzato nelle bande del visibile,
dell'ultravioletto e dell'infrarosso. Si usano, naturalmente, speciali
emulsioni fotografiche: la lunghezza d'onda delle righe spettrali infatti può
essere riconosciuta non solo in base al loro colore, ma, come avviene spesso,
dalla loro posizione relativa.
Spettrofotometro
Lo spettrofotometro è utilizzato
per confrontare l'intensità delle righe di uno spettro con quelle di uno
spettro di riferimento, ottenuto da una sorgente di luce nota. Questa misura
permette di risalire alla concentrazione della sostanza che emette o assorbe la
radiazione elettromagnetica. Lo spettrofotometro è uno strumento utile
soprattutto nello studio di spettri non visibili, poichè gli strumenti
utilizzati per la misurazione della radiazione possono essere bolometri o
cellule fotoelettriche, adatti a quantificare rispettivamente la radiazione
infrarossa e quella ultravioletta.
Reticolo di
diffrazione
Un altro tipo di spettroscopio
d'uso comune, ideato e utilizzato per la prima volta dal fisico tedesco Joseph
von Fraunhofer all'inizio dell'Ottocento, è quello che impiega come elemento
dispersivo un reticolo di diffrazione. Questo dispositivo, che svolge le
medesime funzioni del prisma di vetro, consiste di una superficie metallica o
di vetro su cui sono incise numerose fenditure molto ravvicinate. Un buon
reticolo ha potere di dispersione molto alto e permette quindi di cogliere
meglio numerosi dettagli dello spettro in analisi. Le linee del reticolo
possono anche essere incise su uno specchio concavo, di modo da evitare l'uso
aggiuntivo di una lente focalizzante. Questo tipo di spettroscopio è
particolarmente adatto per lo studio di radiazione nella regione ultravioletta
e dei raggi X. Anche il reticolo, come il prisma, può essere inserito in uno
spettrografo o in uno spettrofotometro.
ANALISI SPETTRALE
La luce viene emessa o assorbita
sotto forma di unità microscopiche o corpuscoli, dette quanti o fotoni. L'energia di un singolo fotone è direttamente proporzionale alla frequenza
di radiazione e quindi inversamente proporzionale alla lunghezza d'onda,
secondo la formula
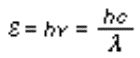
dove h è la costante di Planck e c
è la velocità della luce. Il colore, o la lunghezza d'onda, dei quanti di luce
emessi o assorbiti da un nucleo, da un atomo o da una molecola dipende dalla
loro struttura interna – ed eventualmente dai moti periodici delle particelle
costituenti – che definisce l'energia totale (cinetica più potenziale) del
sistema. In un atomo, l'assorbimento o l'emissione di luce di una determinata
lunghezza d'onda corrisponde alla transizione di un elettrone da un'orbita a
un'altra: lo spettro di un atomo è sempre a righe, e cade nell'intervallo di frequenze
dall'infrarosso al visibile. Per una molecola, l'assorbimento o l'emissione di
radiazione è associata a variazioni dei moti rotazionali o vibrazionali dei
nuclei e al moto periodico degli elettroni intorno a essi: ogni volta che il
modo di vibrazione di una molecola cambia, anche gli elettroni si riassestano,
causando emissione o assorbimento di luce di uno specifico colore. Gli spettri
molecolari si presentano come una banda diffusa che, ad una osservazione con
uno strumento di migliore risoluzione, si può separare in righe distinte, di
frequenza che varia dall'infrarosso all'ultravioletto. L'emissione di
radiazione di frequenza superiore, nella regione dei raggi X, è dovuta a salti
quantici tra stati energetici di nuclei eccitati; essa è divisa in componenti
dette di multipolo elettrico o magnetico, e corrisponde generalmente a
transizioni tra stati a diverso momento angolare.
Dall'analisi della luce emessa o
assorbita da un nucleo, un atomo o una molecola, si possono trarre numerose
informazioni circa la loro struttura e i loro moti periodici caratteristici di
rotazione o vibrazione.
Spettro
continuo
Solidi incandescenti, liquidi o
gas molto densi emettono uno spettro continuo, in cui non sono distinguibili le
righe relative a ciascuna lunghezza d'onda: lo spettro infatti contiene tutte
le frequenze visibili, e l'immagine che ne risulta è simile all'arcobaleno. Uno
spettro continuo può essere analizzato solo con uno spettrofotometro. Nel caso
che il corpo sia un emettitore ideale, ossia un corpo nero, la distribuzione
dell'intensità nelle varie lunghezze d'onda dipende solo dalla temperatura. Due
delle leggi relative alla distribuzione dell'energia in uno spettro continuo
furono definite negli anni intorno al 1893 dal fisico tedesco Wilhelm Wien, che
perfezionò le conclusioni ottenute precedentemente dai fisici austriaci Ludwig
Boltzmann e Josef Stefan. La legge di Stefan-Boltzmann afferma che l'energia
totale irradiata nell'unità di tempo da un corpo nero è proporzionale alla
quarta potenza della temperatura assoluta: la legge di Wien stabilisce inoltre
che, quando aumenta la temperatura, la lunghezza d'onda alla quale corrisponde
l'intensità massima di radiazione emessa si sposta verso valori inferiori, in
misura proporzionale alla variazione di temperatura.
Nel 1900 il fisico tedesco Max
Planck scoprì la terza e più importante legge sulla distribuzione dell'energia
nello spettro di un corpo nero. Mentre era alla ricerca di una legge che
interpolasse i grafici sperimentali, Planck ebbe l'idea che le proprietà
termodinamiche della radiazione termica emessa dalla materia dovessero essere
indipendenti dal meccanismo di emissione e dalla natura degli atomi emettitori:
ipotizzò che l'interazione tra radiazione e materia avvenisse per scambio di
quantità discrete di energia, in seguito chiamate quanti. Questo risultato ebbe
un ruolo fondamentale nello sviluppo della meccanica quantistica.
Righe
spettrali
Lo spettro emesso dai vapori
caldi di una sostanza può essere costituito da un singolo colore, come accade
per il giallo nelle lampade a vapore di sodio, il rosso nelle lampade al neon,
il blu-verde nelle lampade a vapori di mercurio. In questi casi lo spettro
consiste di varie righe, ciascuna relativa a una specifica lunghezza d'onda,
separate una dall'altra da regioni di completa oscurità. Lo spettro
caratteristico dei vapori di sodio contiene il cosiddetto doppietto: due righe
di lunghezza d'onda molto simile, 589,0 e 589,6 nm, dette rispettivamente D2 e D1, non
distinguibili dall'occhio umano, ma osservabili con uno spettroscopio ad alta
risoluzione. In questi casi solo uno spettrografo ad alta risoluzione riesce a
distinguere le righe, strettissime ed estese a una percentuale molto ridotta
dello spettro, che per il resto appare completamente buio. La maggior parte
dell'intensità dello spettro dei vapori di sodio è concentrata nel doppietto:
tuttavia ad alte temperature, quali quelle indotte da un arco elettrico o da
una scintilla elettrica, nello spettro compaiono numerose altre righe più
deboli, determinate da stati atomici eccitati, ovvero corrispondenti a
transizioni elettroniche fra orbitali più periferici rispetto al nucleo.
Il primo spettro a essere
studiato fu quello dell'atomo di idrogeno, che essendo prodotto dall'elemento
dotato di struttura più semplice – un elettrone e un protone – è lo spettro più
semplice da comprendere e descrivere. Alla fine dell'Ottocento, il matematico e
fisico svizzero Johann Jakob Balmer osservò quattro righe nella regione
visibile dello spettro dell'atomo di idrogeno. Egli mostrò che tali righe si
possono ordinare in una serie, oggi nota come serie di Balmer, di cui diede la
formula empirica
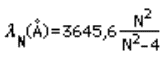
in cui N poteva assumere i valori
3, 4, 5 o 6. Poco tempo dopo, l'astronomo britannico William Huggins scoprì un
altro gruppo di righe spettrali dell'idrogeno, appartenenti alla regione
dell'ultravioletto, che soddisfacevano la formula di Balmer, quando si
assegnavano a N valori maggiori. Sarà Niels Bohr a ricavare una formula per la
descrizione dello spettro dell'idrogeno valida per tutte le serie di righe
dello spettro, nella quale l'espressione di Balmer rientrerà come caso
particolare.
Niels Bohr
.
 Il
LAVORO DI NIELS BOHR
Il
LAVORO DI NIELS BOHR
Intorno al 1913 il fisico danese
Niels Bohr propose una nuova formulazione della teoria dell'emissione di
radiazione da parte degli elettroni in moto orbitale all'interno dell'atomo.
Egli introdusse un modello empirico dell'atomo che associava il modello
classico di Rutherford e la teoria quantistica di Planck; in base a tale
modello derivò una formula generale per l'emissione della radiazione da parte
dell'atomo di idrogeno,
Righe spettrali
dell'idrogeno
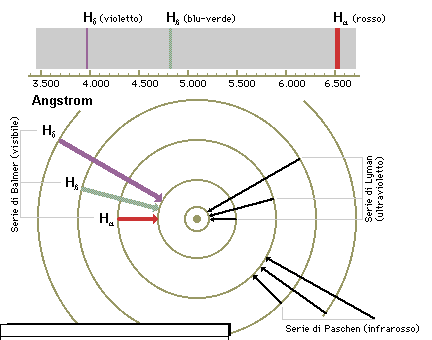 Quando un
elettrone compie una transizione da un livello energetico a un altro, l’atomo
emette fotoni di una particolare energia, osservabili sotto forma di riga di
emissione mediante uno spettroscopio. Nell’atomo di idrogeno, la serie di Lyman
raggruppa le transizioni allo stato fondamentale, la serie di Balmer, nella
regione del visibile dello spettro, comprende le righe relative alle
transizioni al secondo livello energetico e quella di Paschen, nell’infrarosso,
quelle al terzo livello.
Quando un
elettrone compie una transizione da un livello energetico a un altro, l’atomo
emette fotoni di una particolare energia, osservabili sotto forma di riga di
emissione mediante uno spettroscopio. Nell’atomo di idrogeno, la serie di Lyman
raggruppa le transizioni allo stato fondamentale, la serie di Balmer, nella
regione del visibile dello spettro, comprende le righe relative alle
transizioni al secondo livello energetico e quella di Paschen, nell’infrarosso,
quelle al terzo livello.
la quale non solo descriveva le
righe della serie di Balmer, ma prevedeva correttamente l'esistenza di altre
serie di righe nella regione infrarossa e ultravioletta dello spettro,
verificate sperimentalmente solo dopo vari anni. La formula di Bohr portava
alla definizione di una lunghezza particolare espressa dalla relazione
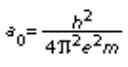
che rappresenta il cosiddetto
raggio dell'atomo di idrogeno, o raggio della prima orbita di Bohr (il suo
valore è pari a 0,5×10-8 m). Assunto il concetto di
quantizzazione dell'azione, Bohr ne dedusse che fossero possibili solo orbite
corrispondenti a determinati valori del raggio (quantizzazione del raggio
dell'orbita), definiti dalla relazione
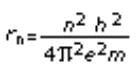
dove n è il numero d'ordine dell'orbita. Pertanto, a un elettrone
occupante l'n-esima orbita, è
attribuita un'energia pari a
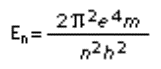
In base a ciò, quando l'elettrone
passa dall'orbita n all'orbita k, la variazione di energia è pari a
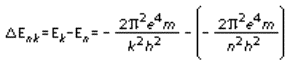
o
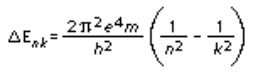
che corrisponde all'emissione o
all'assorbimento di un fotone, a seconda che k
sia minore o maggiore di n.
La lunghezza d'onda ë del fotone
emesso quando l'elettrone passa dall'orbita n
alla k si ottiene uguagliando la
formula di Bohr all'energia del fotone hc/ë,
secondo l'equazione
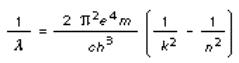
La quantità
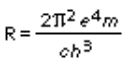
è detta costante di Rydberg (R),
dal nome del fisico svedese Robert Johannes Rydberg. Se si pone k uguale a 2, questa formula si riduce a
quella di Balmer, le cui righe, corrispondenti alle transizioni che hanno come
stato finale la seconda orbita di Bohr, sono date dai diversi valori di n.
Con k uguale a 1 e n
variabile (transizioni dell'elettrone sull'orbita più bassa), si ottiene la
cosiddetta serie di Lyman, le cui righe sono nell'ultravioletto. Per i valori
di k uguali a 3, 4, 5 si hanno
poi, rispettivamente, le serie Paschen, Brackett e Pfund, che raggruppano righe
spettrali dell'infrarosso.
A causa di fattori non
contemplati nella teoria, quali lo spin dell'elettrone o l'effetto Doppler, la
formula di Bohr non rende conto della struttura fine di ogni riga.
Esempi di emissione e assorbimento di fotoni
Quando la luce passa attraverso
un gas di idrogeno i cui elettroni si trovano nel primo stato eccitato, e cioè
nella seconda orbita di Bohr, come ad esempio nelle atmosfere stellari, i
fotoni di lunghezza d'onda corrispondente alle righe della serie di Balmer
vengono assorbiti da questi elettroni, che quindi passano a stati di eccitazione
più alti. L'analisi spettrale della luce bianca che emerge dal gas mostra righe
scure nell'esatta posizione di quelle della serie di Balmer, su un fondo
luminoso. Si tratta di uno spettro di assorbimento.
I due fenomeni della fluorescenza
e della fosforescenza consistono entrambi nell'assorbimento di radiazione da
parte di elettroni dello stato fondamentale e nella conseguente riemissione di
questa radiazione a una lunghezza d'onda maggiore di quella iniziale. Nel
fenomeno della fluorescenza, assorbimento ed emissione di radiazione si
susseguono rapidamente, e dunque il fenomeno si verifica finchè viene mantenuta
la radiazione illuminante. Nella fosforescenza, invece, l'emissione si verifica
più lentamente, pertanto il fenomeno continua anche dopo l'interruzione
dell'illuminazione.
Spettri
caratteristici
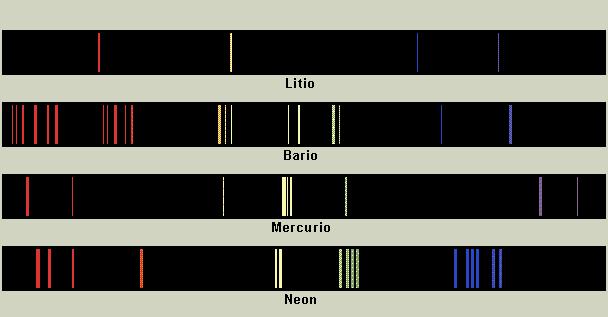 Ciascun
elemento chimico è univocamente identificato dal proprio spettro
caratteristico, che ne rappresenta fedelmente la struttura atomica. Uno spettro
di emissione (in figura) si presenta come una serie di righe luminose su fondo
scuro, ciascuna corrispondente a una specifica lunghezza d’onda: esso si
ottiene quando gli atomi o le molecole della sostanza in esame emettono
radiazione, in seguito a una transizione elettronica tra stati di diversa energia.
Ciascun
elemento chimico è univocamente identificato dal proprio spettro
caratteristico, che ne rappresenta fedelmente la struttura atomica. Uno spettro
di emissione (in figura) si presenta come una serie di righe luminose su fondo
scuro, ciascuna corrispondente a una specifica lunghezza d’onda: esso si
ottiene quando gli atomi o le molecole della sostanza in esame emettono
radiazione, in seguito a una transizione elettronica tra stati di diversa energia.
Atomi a più elettroni
Lo spettro del sodio è più
complesso di quello dell'idrogeno. L'atomo di sodio è composto da 11 elettroni,
di cui 2 orbitano in una nube elettronica più interna, 8 nella zona intermedia,
mentre l'ultimo elettrone si trova in una regione esterna. Sottoponendo il
sodio a una scarica elettrica, si ottiene uno spettro formato da gran parte
degli elettroni atomici; se invece l'eccitazione avviene per mezzo di un arco
elettrico o di una fiamma, il responsabile dell'emissione delle righe spettrali
è principalmente l'elettrone più esterno. Il suo comportamento è piuttosto
simile a quello dell'unico elettrone dell'idrogeno, ma è comunque influenzato
dalla presenza degli altri 10 elettroni: questi provocano la possibilità di
orbite di eccentricità diversa, e di valori diversi del momento magnetico e
angolare orbitale. Ne risultano non solo diverse serie di righe, ma anche i
cosiddetti doppietti e tripletti, ovvero gruppi di due o tre righe molto
ravvicinate, che hanno solo una piccolissima differenza di lunghezza d'onda. Le
serie di righe più importanti dello spettro del sodio sono dette sharp, principal,
diffuse – o anche rispettivamente
S, P, D –; le successive sono riferite con le lettere dell'alfabeto F, G e H.
SPETTRI MOLECOLARI
La maggior parte delle
informazioni che i fisici hanno raccolto sulla struttura dell'atomo proviene da
analisi spettroscopiche. Allo stesso modo, gli spettri molecolari sono stati
essenziali ai chimici per elaborare la struttura di diverse sostanze. Gran
parte delle molecole produce spettri a bande, che consistono in una serie di
bande luminose estremamente ravvicinate, ciascuna simile a un segmento di
spettro continuo, separate da spazi scuri. In ciascuna banda, le spaziature tra
le righe dipendono dal tipo di spettro. Se si tratta di uno spettro
rotazionale, le righe sono molto vicine, poichè i livelli energetici
rotazionali possono venire eccitati da quantità di energia molto piccola e sono
dunque molto vicini uno all'altro; viceversa ai livelli vibrazionali, molto più
distanziati, corrispondono righe spettrali rade. Anche i livelli energetici
elettronici di una molecola possono venire eccitati: le transizioni di elettroni
fra tali livelli danno origine a righe spettrali molto distanti.
Facendo passare uno spettro di
radiazione continua attraverso un liquido o un gas molecolare è possibile
ottenere uno spettro molecolare di assorbimento; esso appare come una serie di
bande scure su uno sfondo luminoso, ed è uno dei meccanismi più utilizzati per
lo studio delle strutture molecolari. In alcuni casi però non è possibile
risolvere le fitte righe delle bande spettrali neppure con strumenti ad
altissima risoluzione.
APPLICAZIONI DELLA
SPETTROSCOPIA
L'analisi spettrale svolge un
ruolo fondamentale in chimica e in astrofisica.
Analisi
chimica
Ogni elemento è univocamente
riconoscibile dal proprio spettro caratteristico. Questo significa che
dall'analisi qualitativa dello spettro di una sostanza sconosciuta, eccitata
con una fiamma, con un arco o una scarica elettrica, è possibile risalire alla
sua composizione. Per identificare composti chimici si usano solitamente
spettri di assorbimento.
Con l'uso di appositi rivelatori
è possibile osservare spettri di radiazioni non visibili, X o gamma. Gli
spettri gamma stanno alla base della tecnica di analisi per attivazione
neutronica, in cui si analizza l'emissione di un campione bombardato con
neutroni. L'analisi dello spettro gamma di una sostanza permette di rivelare
quantità anche microscopiche degli elementi chimici presenti nel campione.
Insieme ad altre tecniche convenzionali di analisi spettroscopica, questa
tecnica trova larga applicazione nelle indagini criminologiche.
La spettroscopia Raman, inventata
nel 1928 dal fisico indiano Chandrasekhara Venkata Raman, ha trovato una
recente applicazione in tutto il mondo nel campo della chimica teorica. Questo
metodo permette, in una molecola, di
rallentare il moto di un determinato gruppo di atomi, e di precisarne la
configurazione. La molecola perciò assorbe radiazione di una determinata
frequenza, e la emette ad una frequenza più bassa, dopo che parte dell'energia
si è tradotta nell'eccitazione dei suoi moti vibrazionali. La luce dello spettro
Raman può essere visibile o ultravioletta.
Sempre nel campo dell'analisi della struttura
molecolare, si collocano due metodi di spettroscopia magnetica: la risonanza
magnetica nucleare (NMR) e la risonanza paramagnetica elettronica, o di spin
elettronico (EPR o ESR). Questi metodi si basano sulla proprietà degli spin
degli elettroni e dei protoni di allinearsi in presenza di un campo magnetico
oscillante. Innanzitutto gli spin di una sostanza campione vengono allineati,
utilizzando un campo magnetico; poi, quando al campione viene applicato un
segnale a radiofrequenza, gli spin si riassestano, generando emissione di
radiazione.
Astrofisica
Le radiazioni emesse dal Sole vengono raccolte da uno
spettrometro e registrate fotograficamente mediante uno spettrografo. Alcune
frequenze vengono assorbite dagli elementi presenti nell’atmosfera solare,
pertanto si osservano nello spettro delle bande nere, dette bande di
assorbimento. Lo studio di queste bande permette di risalire alla natura degli
elementi che costituiscono il Sole.
Spettro delle
radiazioni solari
Le
radiazioni emesse dal Sole vengono raccolte da uno spettrometro e registrate
fotograficamente mediante uno spettrografo. Alcune frequenze vengono assorbite
dagli elementi presenti nell’atmosfera solare, pertanto si osservano nello
spettro delle bande nere, dette bande di assorbimento. Lo studio di queste
bande permette di risalire alla natura degli elementi che costituiscono il
Sole.
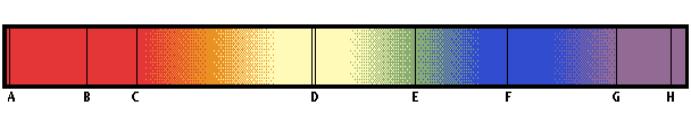
|
A
(infrarosso)
Ossigeno terrestre B
(rosso)
Ossigeno terrestre C
(rosso)
Idrogeno solare D
(giallo)
Sodio solare E
(verde)
Ferro solare F
(blu)
Idrogeno solare G
(viola)
Ferro ed elementi alcalino terrosi solari H
(ultravioletto)
Calcio solare |
L'analisi
spettroscopica della luce del Sole permette un'accurata analisi chimica dei
suoi costituenti.
Le righe di Fraunhofer furono
scoperte all'inizio del XIX secolo come righe di assorbimento nello spettro
solare; si scoprì in seguito che esse potevano essere prodotte anche
dall'assorbimento da parte di elementi presenti nell'atmosfera terrestre.
L'elio fu scoperto nel Sole molto tempo prima che venisse rilevata la sua
presenza sulla Terra. Allo stesso modo, lo studio spettroscopico delle stelle
ha fornito e continua a fornire preziosissime informazioni scientifiche,
impossibili da ottenere nei laboratori terrestri a causa delle particolari
condizioni di pressione e temperatura richieste.
L'analisi spettrale si è rivelata
fondamentale nell'analisi dell'atmosfera dei pianeti e dei satelliti, e nello
studio degli oggetti del sistema solare; ad esempio, per via spettroscopica si
è scoperto che il maggior costituente degli anelli di Saturno è ammoniaca allo
stato di ghiaccio.
Spostamento delle righe spettrali: l'effetto
Doppler
Quando la sorgente che emette la
radiazione che si sta osservando è in movimento rispetto all'osservatore, le
righe dello spettro compaiono spostate rispetto alla loro normale posizione; in
particolare esse appaiono spostate verso il rosso, cioè caratterizzate da
lunghezze d'onda maggiori, se la sorgente si sta allontanando, spostate verso
il violetto nel caso contrario. Questo spostamento di lunghezza d'onda, noto
come effetto Doppler, permette di determinare la velocità della sorgente di
radiazione. L'effetto Doppler osservato negli spettri delle galassie è la prova
che l'universo si sta espandendo.
Quando lo spettro di una stella
si separa periodicamente in doppietti che poi si ricombinano in righe singole
significa che si tratta di una stella doppia, o binaria: le due stelle ruotano
l'una intorno all'altra in modo così ravvicinato da non poter essere distinte
con un telescopio. Quando una delle due si muove verso la Terra, e l'altra
quindi se ne allontana, le righe spettrali della prima appaiono spostate verso
il violetto, mentre quelle della seconda si dirigono verso il rosso, e quindi
si riesce a distinguerle; quando entrambe le stelle si muovono trasversalmente
alla direzione d'osservazione dalla Terra, le righe delle due stelle
coincidono, e sembrano provenire da una stella singola.
Le molecole di un gas sono in
moto costante, a una velocità che dipende dalla temperatura: in ogni istante
dunque alcune molecole si allontanano e altre si avvicinano allo spettroscopio.
La lunghezza d'onda dei fotoni emessi sarà quindi in alcuni casi più lunga, in
altri più corta di quella dei fotoni che verrebbero emessi dagli stessi atomi a
riposo. A causa di questa variabilità della lunghezza d'onda, ogni riga
spettrale appare leggermente allargata. Aumentando la temperatura del gas
aumenta la velocità media delle molecole e, conseguentemente, la larghezza
delle righe. Così, misurando la larghezza di alcune righe spettrali si può risalire
alla temperatura della sorgente, come nel caso del Sole. In molti casi, la
temperatura interna di un corpo celeste è maggiore di quella dei suoi strati
più esterni; uno spettro d'emissione di righe larghe proviene quindi dalla
regione più interna, mentre uno spettro d'assorbimento con righe più strette è
prodotto dall'esterno.
Effetto Mössbauer
Collegato
all'effetto Doppler è l'effetto Mössbauer, scoperto nel 1958 dal fisico tedesco
Rudolf Ludwig Mössbauer. Esso consiste nell'emissione senza rinculo di raggi
gamma da parte di un nucleo, e nel conseguente assorbimento di questi da parte
di un altro nucleo. Perché avvenga l'assorbimento, lo spettro di energia dei
raggi gamma del nucleo emettitore deve quasi coincidere con lo spettro delle
possibili energie di eccitazione dell'assorbitore. La più piccola variazione
nel moto relativo dell'assorbitore rispetto all'emettitore fa sì che l'energia
apparente dei raggi gamma "visti" dall'assorbitore cambi. Muovendo
l'assorbitore o la sorgente, si possono classificare le energie dei raggi gamma
con grande precisione, traendo informazioni utili nello studio dei campi
elettrici e magnetici intorno ai nuclei di un solido. L'effetto Mössbauer può
inoltre fornire un quadro accurato dei moti relativi ed è perciò sfruttato
nell'attracco dei veicoli spaziali.
Fisica nucleare
La spettroscopia ad alta
risoluzione è utile in fisica nucleare per lo studio dell'influenza delle
dimensioni e della forma del nucleo sulla struttura atomica più esterna. Nel
1896 il fisico olandese Pieter Zeeman scoprì che le righe spettrali di una
sorgente posta in un campo magnetico appaiono allargate, o anche separate in
doppietti. Questo fenomeno, noto come effetto Zeeman, fornisce importanti
informazioni sulla struttura atomica. Il cosiddetto effetto Stark, invece,
consiste nella separazione delle righe spettrali nelle loro diverse componenti,
mediante l'applicazione di un forte campo magnetico. La scoperta risale al
1913.