Abstract
Gli
autori hanno compiuto una revisione completa ed attenta della letteratura
sugli effetti dannosi causati dal fumo di sigaretta sui tessuti parodontali,
ed in corso di terapia chirurgica.
Sono
stati valutati tutti i vari
parametri che possono interessare lo studio della parodontopatia nel
soggetto fumatore, sia dal punto di vista anatomico che clinico, per passare
poi ad una revisione critica di quanto più recentemente pubblicato in
relazione alla eziologia e patogenesi della malattia parodontale nel
fumatore.
Nello studio della letteratura a riguardo, viene anche seguito il tempo strettamente chirurgico, con più particolare attenzione alle nuove metodiche di rigenerazione guidata dei tessuti e nella copertura di superfici radicolari esposte.
Introduzione
Il
fumo di sigaretta rappresenta uno dei maggiori fattori di rischio per
numerose patologie, non solo di tipo neoplastico. E’ stato stimato che
solo in Europa causa circa 400.000 morti l’anno tra tumori maligni al
polmone, delle vie aereo-digestive superiori, della vescica e del rene.
Inoltre al tabacco sono imputabili il 25% delle morti per cause
cardiovascolari e l’80% di quelle per malattie croniche dell’apparato
respiratorio.
Anche in campo odontoiatrico numerosi studi clinici hanno dimostrato la correlazione tra fumo di sigaretta, malattie parodontali e neoplasie del cavo orale.
Alcune
ricerche sottolineano la minor attitudine dei fumatori, rispetto ai non
fumatori, a mantenere un buon livello d'igiene orale. Studi più recenti
evidenziano invece una significativa alterazione della normale anatomia
parodontale attribuendo al fumo un'azione diretta e non legata alla minor
capacità dei fumatori a mantenere un sufficiente controllo di placca.
Aspetti
clinici
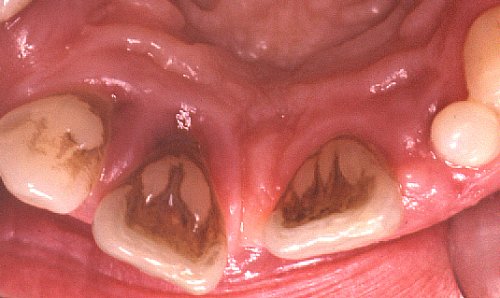
All’esame
obiettivo dei pazienti fumatori affetti da malattia parodontale si rileva
una gengiva marginale fibrotica con margini ispessiti, il rossore e
l’edema non sono sempre evidenti anche se in fasi avanzate di malattia.
L’analisi
strumentale dimostra un maggiore valore di sondaggio soprattutto nei settori
vestibolari degli elementi anteriori e nelle zone palatali dei posteriori.
Si possono apprezzare recessioni gengivali con maggior frequenza nei
soggetti fumatori con localizzazione vestibolare anteriore. Inoltre si
registra una maggiore incidenza di malattia parodontale nei giovani fumatori
rispetto ai coetanei che non fanno uso di tabacco.
E’ dimostrato che il fumo diminuisce l’aspetto dei sintomi clinici dell’infiammazione ( sanguinamento, edema, ecc.) malgrado sia associata ad un notevole accumulo di placca e tartaro ed un maggior grado di patologia con perdita di attacco, perdita di supporto osseo e formazione di tasca.
Tutto
ciò dimostra che il paziente fumatore presenta più tardivamente i sintomi
della malattia parodontale pur trovandosi in fasi avanzate di patologia con
la conseguenza da parte dell’operatore di sottovalutare l’entità della
malattia.
Sempre
clinicamente è apprezzabile invece con la cessazione del fumo un aumento
del sanguinamento in seguito alle manovre d’igiene orale domiciliare e più
in generale un riacutizzarsi dei sintomi tipici della gengivite. Questo
periodo può durare da alcuni mesi ad un anno ed in seguito la gengiva tende
a riacquistare le normali caratteristiche anatomiche perdendo l’aspetto
fibrotico ispessito. Inoltre nella maggior parte dei casi la perdita di
attacco si arresta o diminuisce sensibilmente. E' importante perciò
informare il paziente della possibile riacutizzazione della malattia alcune
settimane dopo l’eliminazione del fumo, in modo da motivarlo e renderlo
consapevole delle difficoltà iniziali.
Epidemiologia
In
passato alcuni contributi scientifici hanno sottolineato che la più alta
percentuale di fumatori è tra le classi sociali inferiori dal punto di
vista economico e culturale e ciò potrebbe spiegare il più basso livello
d’igiene orale riscontrato in questi pazienti.
Linden
e Coll. Hanno valutato la profondità di tasca, perdita d'attacco, indici di
placca, presenza di tartaro e sanguinamento al sondaggio su un gruppo di 82
pazienti (21 fumatori e 61 non fumatori) di età compresa tra i 20 e i 33
anni che nell’arco di un anno afferivano in un ambulatorio odontoiatrico
per visite periodiche di controllo.
I
fumatori presentavano un numero maggiore di siti con profondità di
sondaggio maggiore di 4 mm e perdita d'attacco maggiore di 2 mm. La ricerca
dimostrava che anche in una popolazione di pazienti che frequentano
regolarmente un ambulatorio odontoiatrico e quindi motivati a mantenere una
buona igiene orale, il fumo è il maggiore fattore di rischio associato ad
una più veloce distruzione parodontale.
Bergstrom
e Coll. hanno valutato invece il riassorbimento osseo in associazione al
fumo su un gruppo di 210 igieniste dentali svedesi di età compresa tra i 24
ed i 60 anni. Di queste il 30% erano fumatrici, il 32% ex-fumatrici, ed il
38% non avevano mai fumato. Mediante esami radiografici endorali
“bite-wing” veniva valutata la perdita ossea prendendo come punti di
riferimento la giunzione smalto-cemento e la sommità del setto interdentale
mesialmente e distalmente su cinque denti posteriori escludendo le superfici
mesiali dei primi premolari e le superfici distali dei secondi molari. Fu
riscontrato un alto livello d’igiene orale sia sui fumatori che sui non
fumatori, ma nei soggetti fumatori era stata rilevata una maggiore distanza
dal setto osseo interdentale alla giunzione smalto-cemento e risultava più
significativa in coloro che consumavano più di 10 sigarette al giorno.
Pertanto lo studio dimostrò un maggiore riassorbimento osseo
interprossimale significativamente maggiore nei fumatori rispetto a coloro
che non avevano mai fumato.
Locker
e Leake esaminarono la perdita di attacco su una popolazione di 624
individui scelti casualmente in 4 comunità nello stato dell’Ontario in
Canada. L’età media era di 62,3 anni ed in questo gruppo il 55,4% erano
donne ed il 95,5% di razza bianca. Il livello di attacco connettivale era
misurato su tutti i denti, in due siti per dente. Successivamente erano
calcolati per ciascun soggetto la percentuale dei siti con perdita di
attacco superiore ai 2 mm e la percentuale dei soggetti con una perdita
media di attacco giudicata severa (>3,83 mm). I fumatori abituali
mostravano una più alta percentuale di siti con perdita di attacco
superiore ai 2 mm (85% vs 16%) ed una maggiore porzione di soggetti con una
severa perdita di attacco (34% vs 16%) rispetto ai non fumatori.
Lavori
di Bergstrom e Coll. e di Mac Farlane e Coll. dimostrano che nei pazienti
affetti da parodontite rapidamente progressiva e gengivite ulcero necrotica
acuta è stata osservata un’alta incidenza di fumatori, mentre per quanto
riguarda soggetti affetti da parodontite refrattaria la percentuale di
fumatori è pari al 90%.
Anche
rispetto agli ex-fumatori coloro che non smettono presentano maggiori danni
parodontali con valori di maggiore severità sulla profondità di sondaggio,
perdita di attacco e riassorbimento osseo.
Eziologia
Alcuni
lavori scientifici hanno preso in esame la presenza dei principali batteri
responsabili della distruzione parodontale e l’individuare le eventuali
differenze batteriche tra fumatori e non fumatori.
Preber
e Coll. non hanno trovato differenze significative, per quanto riguarda la
presenza di A. Actinomycetemcomitans, P. Gengivalis e P. Intermedia, su un
campione di 145 pazienti, 83 fumatori e 62 non fumatori, con parodontite
avanzata.
Stoltenberg
e Coll. hanno analizzato la presenza di cinque diversi ceppi batterici su un
campione di 126 non fumatori e 63 fumatori simili tra loro per età, sesso,
indice di placca e presenza di tartaro. Le specie analizzate erano P.
Gengivalis, A. Actinomicetemcomitans, P. Intermedia, Eikenella Corrodens e
Fusobacterium Nucleatum e per nessuna di questi erano presenti differenze
significative tra fumatori e non fumatori relativamente al numero dei
batteri per ciascuna specie.
Altri studi hanno valutato il livello di microorganismi componenti la microflora orale, A. Actinomycetencomitans, P.gengivalis, P.intermedia, in soggetti fumatori abituali e non fumatori, affetti o no da malattia parodontale ed anche in condizioni di gengivite sperimentale (Lie e Coll., Renvert e Coll.).
Nessuna rilevante relazione si e’ osservata tra la presenza di questi microorganismi periopatogeni e la abitudine al fumo cronico, ne’ tantomeno esiste una provata relazione tra le singole specie batteriche ed i differenti livelli di infiammazione.
Una notazione particolare comunque riguarda l’Actinomycetaencomitans, il quale nei soggetti fumatori risulta quasi impossibile da eradicare.
Patogenesi
I
meccanismi indotti dal fumo a livello dei tessuti parodontali sono diversi
anche perché sono numerosi i componenti del tabacco con attività patogene
non sempre uguali tra loro.
Il
tabacco contiene numerose sostanze vasoattive e citotossiche e tra queste la
nicotina, presente come maggior componente, ha dimostrato di essere in grado
di penetrare le cellule dell’epitelio, inducendo variazioni vascolari nel
tessuto connettivo ed alterando la funzionalità dei fibroblasti. Mediamente
una sigaretta contiene 1 mg di nicotina. Nel plasma di fumatori abituali si
rilevano concentrazioni medie di nicotina variabili tra i 22.6 ed i 73 ng/ml
mentre nel fluido crevicolare questa concentrazione può raggiungere i
250ng/ml. I componenti chimici dannosi contenuti nel tabacco oltre alla
nicotina sono oltre 4000 ed i principali responsabili di danni
all’organismo umano sono suddivisi in composti solidi, particellari e
gassosi. I composti di tipo solido possono avere un effetto gangliomimetico,
come la nicotina, irritante come i fenoli e cancerogeno come gli indoli e i
carbazoli. I composti di tipo gassoso possono avere effetto irritante e
ciliotossico, come l’acetaldeide, l’isoprene, l’acido cianidrico e gli
ossidi di azoto e di zolfo, mentre sono considerati cancerogeni il benzene
ed il monossido di carbonio.
Pindborg
nel 1949 ha sostenuto che la nicotina determina una vasocostrizione a
livello della gengiva marginale determinando così un inadeguato apporto
nutritizio ed una diminuita resistenza alle infezioni.
Studi
più recenti condotti su animali ed esseri umani non hanno però confermato
questo effetto della nicotina.
Martinez-Canut
e Coll. hanno mostrato come il numero di sigarette consumate sia legato ad
una maggior gravità della malattia parodontale.
Su
un campione di 889 pazienti tra i 21 ed i 76 anni con il 47,4% di non
fumatori ed il 52,6 di fumatori, sono stati valutati recessioni gengivali,
profondità di sondaggio, livello di attacco e mobilità dentaria. In questo
studio fumatori che consumavano meno di 10 sigarette al giorno non
presentavano differenze significative rispetto ai non fumatori per quanto
riguarda i livelli di attacco. Al contrario fumatori con consumo giornaliero
tra le 10 e le 20 o superiore alle 20 presentavano, rispetto ai non
fumatori, un incremento della perdita di attacco del 5% e 10%
rispettivamente. Questo studio suggerisce come l’effetto clinico possa
essere legato alla quantità di tabacco consumato anche se, come del resto
in altri studi, non viene preso in esame da quanto tempo il paziente abbia
iniziato a fumare. Probabilmente anche il tempo, oltre alla quantità di
tabacco consumata, ha un’influenza nell’aggravamento della malattia
parodontale.
Johnson
e Coll. in uno studio condotto su 13 cani, osservarono che la
somministrazione sistemica (2,5 mg/kg/die) o topica (8 mg/kg/die) di
nicotina per 28 giorni non determinava significative variazioni del flusso
sanguigno pulpare. Le concentrazioni utilizzate erano equivalenti al consumo
di circa 1,5 pacchetti di sigarette al giorno.
Baab
e Coll. in uno studio condotto su 12 volontari di età compresa tra i 19 ed
i 25 anni, riscontrarono che il fumo di sigaretta determinava un aumento,
piuttosto che una diminuzione, della circolazione sanguigna a livello della
gengiva marginale.
Probabilmente
la teoria che il fumo alteri un già compromesso flusso sanguigno gengivale
potrebbe essere dovuto ad un effetto tossico della nicotina, o di altri
componenti del tabacco, su specifiche funzioni cellulari.
Un
modello per la patogenesi della malattia parodontale nei fumatori potrebbe
essere individuato in un metabolismo difettoso dei tessuti molli, risultante
in una alterazione nel turnover tessutale, nella guarigione e nel
mantenimento dell’attacco parodontale.
Hanes
e Coll. dimostrarono che fibroblasti gengivali umani in coltura legano ed
accumulano nicotina rapidamente, con un meccanismo aspecifico,
determinandone la presenza di alti livelli intracellulari. Gli Autori
ipotizzarono che la presenza di nicotina a livello intracellulare alterasse
i normali processi cellulari, quali la sintesi di collageno e la sintesi
proteica, e potesse quindi risultare in una alterazione dei meccanismi di
guarigione.
Chamson
e Coll. dimostrarono una minore produzione di collageno di tipo III in
colture di fibroblasti trattate con 35 nmol/ml di nicotina.
Raulin
e Coll. indagarono su altre linee di fibroblasti considerando i cambiamenti
relativi alla morfologia e
attacco ai substrati dopo esposizione delle cellule alla nicotina. La
concentrazione di quest’ultima usata variava dai 25 ai 400 ng/m,
equivalenti o superiori alle concentrazioni presenti nel plasma dei fumatori
abituali.
Anche
alle concentrazioni più basse testate, le cellule, esaminate al microscopio
ottico, mostravano una perdita del normale allineamento che caratterizza i
fibroblasti coltivati in monostrato ed apparivano disorganizzate e con
frequenti sovrapposizioni.
Al
microscopio elettronico a scansione le cellule presentavano, all’aumentare
delle concentrazioni di nicotina, la formazione
di microvilli e filopodi sulla superficie plasmatica.
Questi
prolungamenti cellulari, generalmente associati alla locomozione cellulare
stessa, erano più frequenti in prossimità del substrato di coltura e gli
Autori ipotizzavano che questi fossero degli adattamenti della cellula
stessa che cercava di aderire a zone del substrato meno contaminate da
nicotina.
Secondo
gli Autori questi risultati potrebbero essere messi in correlazione con la
minor riduzione di profondità di sondaggio che si osserva nei fumatori,
dopo terapia non chirurgica. Infatti, una minor capacità di adesione dei
fibroblasti potrebbe rendere gli stessi più suscettibili alla malattia
parodontale e meno suscettibili alle procedure per la formazione di nuovo
attacco. In concomitanza con le alterazioni cellulari riscontrate, si notava
la presenza di un accresciuto numero di vacuoli intracellulari, probabile
dimostrazione della presenza di nicotina a livello intracellulare prima
della sua escrezione o metabolizzazione.
Peacock
e Coll. dimostrarono, al contrario, un positivo effetto della nicotina a
livello cellulare riguardo all’attacco di fibroblasti gengivali umani al
substrato di coltura ed un modesto effetto stimolatorio sulla proliferazione
di fibroblasti per concentrazioni di nicotina simili a quelle osservate in
fumatori occasionali.
Comunque
con maggiori concentrazioni di nicotina, simili a quelle osservate in forti
fumatori, il numero delle cellule in coltura diminuiva suggerendo un effetto
diretto sul metabolismo cellulare.
Fang
e Coll. dimostrarono che basse concentrazioni di nicotina sopprimono la
proliferazione cellulare di osteoblasti.
Monaco
e Coll. hanno valutato l’effetto di alte concentrazioni di nicotina,
simili a quelle che potrebbero essere osservate in forti fumatori, su
culture di fibroblasti umani. Per queste concentrazioni è stata rilevata
una inibizione nella proliferazione cellulare pari a circa il 30% rispetto
ai controlli.
Noble
e Penny analizzarono la chemiotassi dei leucociti prelevati dal circolo
venoso periferico di 14 fumatori e di 13 non fumatori. Il gruppo dei
fumatori subiva il prelievo al mattino, per valutare l’effetto di una
notte di astensione, e subito dopo aver fumato due sigarette contenenti
circa 1,6 mg di nicotina.
La
chemiotassi ed il numero dei leucociti risultavano significativamente
depressi nei fumatori rispetto ai non fumatori ed ai fumatori dopo una notte
di astensione. Gli Autori ipotizzavano la presenza nel sangue di un labile
fattore leucotossico legato al consumo di sigarette; d’altra parte la
nicotina, potente stimolatore del rilascio di catecolamine, aumenta
temporaneamente la concentrazione del 3’, 5’ adenosin monofosfato
ciclico (AMP) che in certi casi influenza negativamente la chemiotassi dei
leucociti polimorfonucleati.
Kenney
e Coll. analizzarono la fagocitosi di leucociti polimorfonucleati prelevati
dal cavo orale di 9 fumatori (consumo > 20 sigarette), con età media di
26 anni.
Nei
fumatori la fagocitosi appariva significativamente ridotta rispetto ai non
fumatori. Inoltre il prelevamento dei leucociti, dopo il consumo di una
sigaretta, risultava in un ulteriore depressione della fagocitosi che
appariva più evidente nei non fumatori rispetto ai fumatori.
Gli
Autori ipotizzavano un’alterazione dei polimorfonucleati quale
responsabile della maggiore suscettibilità della gengiva all’attacco
batterico.
Kraal
e Coll. osservarono che un concentrato di fumo di sigarette, dissolto in
acqua fino ad ottenere una concentrazione di 5 mg di residuo non volatile
per ml, era inibitorio nei confronti della migrazione di leucociti
polimorfonucleati prelevati dal solco gengivale di cani Beagle.
Eichel
e Coll. riportarono che l’esposizione del cavo orale al fumo di tabacco,
anche di una sola sigaretta, fornisce materiale tossico in quantità
sufficiente da inibire completamente la funzione dei leucociti ivi presenti
ed esposti a questo materiale.
Bridges
e Coll. analizzarono sia i componenti volatili sia quelli non volatili del
fumo di sigarette e dimostrarono per entrambi un effetto inibitorio nei
confronti della chemiotassi dei polimorfonucleati isolati dalla circolazione
venosa periferica di volontari di sesso maschile non fumatori e con età
compresa tra i 21 ed i 35 anni.
Holt
e Coll. studiarono l’effetto del fumo sulle cellule della serie
immunitaria (linfociti e macrofagi), su fibroblasti e su cellule epiteliali
e notarono che le prime sono più sensibili all’effetto tossico dei vari
componenti presenti nel tabacco.
Secondo
Bostrom e Coll, risulta di fondamentale importanza nella patogenesi della
malattia parodontale nei soggetti fumatori, l’intervento della TNF-a,
una citochina proinfiammatoria prodotta dai leucociti (monociti/macrofagi)
in risposta all’aggressione batterica, e
responsabile della distruzione del tessuto collagene e della lisi
ossea.
Lo studio
da essi condotto, dimostra come nel fluido crevicolare (GCF), il livello
della citochina TNF-a, sia assai piu’ elevato nei soggetti fumatori se rapportato a quello dei
non fumatori, mentre i valori di albumine, IgA e IgG si mantengono
equivalenti tra fumatori e non.
Altro parametro di valutazione studiato da Dinsdale e Coll. è quello del differenziale di temperatura subgengivale fra soggetti fumatori e non. Risulterebbe secondo questi autori, che la temperatura sublinguale sia piu elevata nei fumatori.
Su
siti di rilevazione parodontale invece, la temperatura appare piu’ elevata
in soggetti fumatori, se i siti rilevati sono affetti da malattia
parodontale, viceversa se i siti di rilevazione sono sani la temperatura
risulta piu’ bassa nei soggetti non fumatori.
Effetto del fumo sulla terapia
parodontale
Preber
e Coll. hanno dimostrato che la risposta alla terapia sembra essere diversa
nei fumatori in quanto la riduzione della profondità del sondaggio dopo la
levigatura radicolare è minima, mentre a distanza di un anno da interventi
di chirurgia parodontale è maggiore la riformazione delle tasche.
Cortellini
e Coll. riscontrarono una minore formazione di nuovo attacco, in fumatori,
dopo una terapia chirurgica con rigenerazione guidata dei tessuti
parodontali tramite uso di membrane di Gore-tex.
Sweet
e Butler analizzarono l’effetto del fumo su un campione di 200 pazienti
sottoposti ad estrazione bilaterale di terzi molari inferiori in completa
inclusione.
Si
verificava osteite alveolare nel 12% nei fumatori e del 2,6% nei non
fumatori. Inoltre risultava del 26,3% l’incidenza dell’osteite in coloro
che dichiaravano di aver fumato nell’immediato post-operatorio nonostante
l’invito del chirurgo ad astenersi.
Gli
Autori concludono affermando la necessità di evitare il consumo di
sigarette per almeno cinque giorni dopo aver subito un intervento di
chirurgia parodontale.
Crawford
e Coll. valutarno come influiva il fumo nei pazienti sottoposti a terapia
implantare e dimostrarono che furono maggiori i fallimenti nei soggetti
fumatori rispetto a coloro che non fumavano.
Goldminz
e Coll. conducendo studi dermatologici hanno evidenziato una maggiore
suscettibilità dei fumatori ed ex fumatori, a sviluppare necrosi dei
tessuti dopo interventi di chirurgia a lembo od innesti cutanei. Gli Autori
attribuivano alla nicotina e al monossido di carbonio l’influenza negativa
alla microcircolazione favorendo così la necrosi del lembo o
dell’innesto.
L’astensione
dal fumo due giorni prima di sottoporsi ad interventi di chirurgia e
protratta per una settimana veniva consigliata per i forti fumatori. Questi
risultati anche se ottenuti da sperimentazioni eseguite in diversi distretti
corporei, sono comunque indicativi ed importanti nello studiare le
complicanze post-chirurgiche nel cavo orale in soggetti fumatori.
Secondo
lo studio di Baumert e Coll., nella valutazione degli effetti del fumo sulla
risposta a terapia parodontale, si evidenzia come
l’azione del fumo comporti una minore risposta di guarigione sui
tessuti. In particolare si e' valutato come dopo terapia i soggetti fumatori
presentano una minore riduzione della profondita’ di sondaggio, ed un
minor recupero del livello di attacco rispetto ai non fumatori.
Secondo
Trombelli e Scabbia, mentre durante GTR in soggetti affetti da recessioni di
classe I e II di Miller la risposta dei tessuti non mostra sensibili
variazioni nella fase prechirurgica, viceversa dopo chirurgia mostra
notevoli differenze nella copertura radicolare 57% nei fumatori e 78% nei
non fumatori.
In
conclusione i risultati indicano come il trattamento di copertura radicolare
mediante GTR in casi di recessione gengivale e fumo di sigaretta siano non
compatibili.
Conclusioni
I
problemi correlati al fumo che sono stati valutati permettono ai ricercatori
di ritenere che il fumo crea sul parodonto effetti dannosi, alterandone la
salute e le possibilità di difesa.
Il
fumo contiene sostanze potenzialmente tossiche per i tessuti parodontali,
fra queste la nicotina è stata la più studiata mentre altre componenti (nitrosamine)
sono state analizzate più recentemente.
L’esposizione
al fumo dei tessuti parodontali per un periodo più o meno lungo è
sicuramente un elemento importante nell’eventuale quantificazione del
danno biologico.
I
diversi Autori sono in genere concordi nel sostenere che il numero di
sigarette necessario per ottenere un effetto clinico significativo deve
essere superiore alle dieci unità per almeno due anni.
La
modificazione della placca batterica, collegata ad una compromessa
funzionalità dei leucociti polimorfonucleati, altera nel processo
infiammatorio l’efficienza della fase cellulare, in particolare della loro
capacità fagocitaria e permette un peggioramento o almeno una maggiore
difficoltà di risposta alle terapie parodontali. Quindi nel complesso vi è
una globale modificazione della risposta infiammatoria all’insulto
batterico e del processo riparativo.
Da
questo possono derivare ovviamente gravi danni alle strutture parodontali
con infiammazione cronica, aumento della profondità di sondaggio, lesione
del legamento parodontale, perdita di osso alveolare, che in casi gravi può
evolvere nella perdita di elementi dentari o insuccessi in implantologia.
L’insieme
di questi dati suggerisce che essendo i fumatori più suscettibili alla
malattia parodontale e meno sensibili alle terapie parodontali
convenzionali, bisogna valutare attentamente questi dati prima di
intraprendere un qualsiasi tipo di trattamento. Sarà inoltre di
fondamentale importanza avvertire il paziente riguardo alla maggiore probabilità del
fallimento della terapia.
Riassunto
Gli
autori esaminano l’associazione del fumo alla malattia parodontale
rilevando dati scientifici dalla letteratura internazionale. Sono descritte
le caratteristiche del parodonto nel fumatore e vengono analizzati gli
aspetti epidemiologici, eziologici e
patogenetici del problema. Vengono infine considerati i risultati della
terapia chirurgica sui fumatori.
…………………..
Parola
chiave
Fumo
Malattia
Parodontale
Nicotina
Bibliografia
1.
ARMITAGE T.K., DOLLERY C.T.,
GEORGE C.F., HOUSEMAN T.H., LEWIS P.J.,TURNER D.M.: “Absorpion and
metabolism of nicotine from cigarettes.” British Med. J., 4: 313-316, 1975
2.
ARNO A., WAERHAUG J., LOVDAL
A., SHEI O.: “Incidence of gingivitis as related to sex, occupation,
tobacco compsumption, toothbrushing and age.” Oral Surg., 11: 287-595,
1958
3.
BAAB D.A., OBERG P.A.: “The
effect of cigarette smoking on gingival blood flow in humans.” J. Clin.
Periodontol., 14: 418-424, 1987
4.
BAUMERT M., JOHNSON G.,
KALDAHL W., PATIL K., KALKWARF K.L.: “The effect of smoking and the
response to periodontal therapy.” J. Clin. Periodontol., 2: 91- 97, 1994
5.
BENOWITZ N.L., PEYTON J. III:
“Nicotine and carbon monoxide intake from high and low-yield
cigarettes.” Clin. Pharmacol. Ther., 8: 265-270, 1984
6.
BERGSTROM J.: “Oral hygiene
compliance and gingivitis expression in cigarette smokers.” Scand. J. Dent. Res., 98: 497-503, 1990
7.
BERGSTROM J., ELIASSON S.,
PREBER H.: “Cigarette smoking and periodontal bone loss.” J.
Periodontol., 62: 242-246, 1991
8.
BERGSTROM J., BLOMLOFF L.:
“Tobacco smoking major risk factor associated with refractory periodontal
disease.” J. Dent. Res. Abst., 71: 297, 1992
9.
BERGSTROM J., FLODERUSMYRHED
B.: “Co-twuin control study of the relationship betweensmoking and some
periodontal disease factors.“ Comunity Dent. Oral. Epidemiol., 11:
113-116, 1983
10.
BERGSTROM J., ELIASSON S.: “Noxius effect of cigarette smoking on
periodontal healt.” J. Periodont. Res., 22: 513-517, 1987
11.
BERGSTROM J., PREBER H.: “Tobacco use as a risk factor.” J.
Periodontol., 65: 545-550, 1994
12.
BOLIN A., LAVSTEDT S., FRITHIOF L., HENRIKSON C.O.: “Proximal
alveolar bone loss in a longitudinal radiographic investigation: IV. Smoking
and other factors influencing the progress in a material of individuals with
at least 20 remaining teeth.” Acta Odontol. Scand., 44: 263-269, 1986
13. BOSTROM
L.,LINDER LE.,BERGSTROM J.: “Clinical expression of TNF-a in smoking associated periodontal disease.” J. Clin. Periodontol., 10:
767-773, 1998
14.
BRIDGES R.B., HSIEH L.: “Effects of cigarette smoke fractions on
the chemotaxis of polymorphonuclear leukocytes.” J. Leukocyte Biol., 40:
73-85, 1986
15.
CHAMSON A., FREY J., HIVERT M.: “Effects of tobacco smoke extracts
on collagen byosinthesis by fibroblasts cell cultures.” Toxicol. Environ.
Healt, 19: 921-925, 1982
16.
CORTELLINI P., PINI PRATO G., TONETTI M.: “Effect of smoking on
periodontal regeneration (GTR).” J. Dent. Res. Abst. 1472, 1994
17.
CRAWFORD P.R.: “All implants succed—all implants fail. Part
two.” J. Can. Dent. Assoc. 55(6):461-463, 1989
18.
DINSDALE C., RAWLINSON A., WALSH T.: “Subgingival temperature in
smokers and non smokers with periodontal disease.” J. Clin. Periodontol.,
10: 761- 766, 1997
19.
EICHEL B., ARTO SHAHRIK H.: “Tobacco smoke toxicity: loss of human
oral leukocyte function and fluid-cell metabolism.” Science, 166:
1424-1428, 1969
20.
FANG M.A., FROST P.J., IIDAKLEIN A., HAHN T.J.: “Effects of
nicotine on cellular function in UMR 106-01 osteobast-like cells.” Bone,
12: 283-286, 1991
21.
FUNG C.K.Y., CORBET E.F.: “Gingival bleeding response in smokers
and non-smokers.” J. Dent. Res., abst. 541, 1995
22.
GIANNOPOULOU C., GEINOZ A., CIMASONI G.: “Effects of ncotine on
periodontal ligament fibroblasts in vitro.” J. Clin. Periodontol., 1:
49-55, 1999
23.
GOLDMINZ D., BENNET R.G.: “Cigarette smoking and flap and
full-thickness graft necrosis.” Arch. Dermatol., 127: 1012-1015, 1991
24.
HABER J., KENT R.L.: ”Cigarette smoking in a periodontal
practice.” J. Periodontol., 63: 100-106, 1992
25.
HABER J., WATTLES J., CROWLEY M., MANDELL R., JOSHIPURA K., KENT
R.L.: “Evidence for cigarette smoking as a major risk factor for
periodontitis.” J. Periodontol., 64: 16-23, 1993
26.
HABER J.: “Smoking is a major risk factor for periodontitis.”
Curr. Opin.in Periodontol., 12-18, 1994
27.
HANES P.J., SCHUSTER G.S., LUBAS S.: “Binding uptake and release of
nicotine by human gingival fibroblasts.” J. Periodontol., 62: 147-152,
1991
28.
HILL P., MARQUARDT H.: “Plasma and urine changes after smoking
different brands of cigarettes.” Clin. Pharmacol. Ther., 5: 652-658, 1980
29.
HOLT P.G., BARTHOLOMAEUS W.N., KEAST D.: “Differential toxicity of
tobacco smoke to various cell types including those of the immune system.”
Ajebac, 52 (Pt.1): 211-214, 1974
30.
ISMAIL II., BURT B.A., EKLUND S.A.: “Epidemiologic patterns of
smoking and periodontal disease in the United States.” J. Am. Dent.
Assoc., 106: 617-623, 1983
31.
JOHNSON W.T., JOHNSON G.K., TODD G.L., FUNG Y.K.: “Effects of
systemic and topical nicotine on pulpal blood flow in dogs.” Endod. Dent.
Traumatol., 9: 71-74, 1993
32.
KENNEY E.B., KRAAL J.H., SAXE S.R., JONES J.: “The effect of
cigarette smoke on human oral polymorphonuclear leucocytes." J.
Periodontal Res., 12: 227-234, 1977
33.
KRAAL J.H., CHANCELLOR M.B., BRIDGES R.B., BEMIS K.G., HAWKE J.E.:
“Variations in the gingival polymorphonuclear leukocyte migration rete in
dogs induced by chemotactic autologous serum and migration inibitor from
tobacco smoke.” J. Periodontal Res., 12: 242.249, 1977
34.
LEONE C., BURKLEY T., MONACO G., LAI Y.L., LIMB L.: “Nicotine
effect of fibroblasts.” J. Dent. Res., abst. 1540, 1995
35.
LIE M.A., VAN DER WEIJDEN G.A.,TIMMERMAN M.F.,LOOS B.G.,VAN
STEEMBERGEN T.J.M., VAN DER VELDEN U.: “Oral microbiota in smokers and non
smochers in natural and experimentally-induced gingivitis.” J. Clin.
Periodontol., 25: 677-686, 1998
36.
LIE M.A., TIMMERMAN M.F., VAN DER VELDEN U., VAN DER WEIJDEN G.A.:
“Evaluaton of 2 methods to assess gingival bleeding in smokers and non
smokers in natural and experimental gingivitis.” J. Clin. Periodontol.,
25: 695-700, 1998
37.
LINDEN G.J., MULLARY B.H.: “Cigarette smoking and periodontal
destruction in young adults.” J. Periodontol., 65: 718-723, 1994
38.
LOCKER D., LEAKE J.L.: “Risk indicators and risk markers for
periodontal disease experience in older adults living indipendently in
Ontario, Canada.” J. Dent. Res., 72: 9-17, 1993
39.
MAcGREGOR I.D.M.: “Toothbrushing efficiency in smokers and non
smokers.” J. Clin. Periodontol., 11: 313-320, 1984
40.
MAcFARLANE G., HERZBERG M., WOLFF L., HARDE N.: “Refractory
periodontitis associated with abnormal polymorphonuclear leukocyte
phagocytosis and cigarette smoking.” J. Periodontol., 63: 908-913, 1992
41.
MARTINEZ-CANUT P., LORCA A., MAGAN R.: “Smoking and periodontal
disease severity.” J. Clin. Periodontol., 22: 743-749, 1995
42.
MONACO G., CHECCHI L.: “Fumo e malattia parodontale. Rassegna della
letteratura.” Prev. & Assist. Dent., 4: 11-16, 1996
43.
NOBLE R.C., PENNY B.B.: “Comparison of leukocyte count and function
in smoking and non-smoking young men.” Infection and Immunity, 9: 550-555,
1975
44.
PEACOCK M.E.,
SUTHERLAND D.E., SCHUSTER G.S., BRENNAN W.A., O’NEAL R.B., STRONG S.L., E
COLL.: “The effect of nicotine on reproduction and attachment of human
gingival fibroblasts in vitro.” J. Periodontol., 64: 658-665, 1993
45.
PERSSON L., BERGSTROM J., GUSTAFSSON A., ASMAN B.: “Tobacco smoking
and gingival neutrophil activity in young adults.”
J. Clinic. Periodontol., 1: 9-13, 1999
46.
PINDBORG J.J.: “Tobacco and gingivitis. II. Correlation between
consumption of tobacco, ulcero-membranous gingivitis and calculus.” J.
Dent. Res., 28: 460-463, 1949
47.
PREBER H., BERGSTROM J., LINDER L.E.: “Occurence of
periodontophatogens in smoker and non-smoker patients.” J. Clin.
Periodontol., 19: 667-671, 1992
48.
PREBER H., BERGSTROM J.: “The effect of non-surgical treatment on
periodontal pockets in smokers and non-smokers.” J. Clin. Periodontol.,
13: 319-323, 1985
49.
PREBER H., BERGSTROM J.: “Effect of cigarette smoking on
periodontal healing following surgical therapy.” J. Clin. Periodontol.,
17: 324-328, 1990
50.
PREBER H., LINDER L., BERGSTROM J.: “Periodontal healing and
periodontogenic microflora in smokers and non-smokers.” J. Clin.
Periodontol., 12: 946-952, 1995
51.
RAULIN L.A., McPHERSON III J.C., McQUADE M.J., HANSON B.S.: “The
effect of nicotine on theattachment of human fibroblasts to glass and human
root surfaces in vitro.” J. Periodontol., 5: 318-325, 1988
52.
RENVERT S., DAHLEN G., WIKSTROM M.: “The clinical and
microbiological aspects of non-surgical periodontal therapy in smokers and
non-smokers.” J. Clin. Periodontol., 2: 153-157, 1998
53.
SHEIHAM A.: “Periodontal disease and oral cleanliness in tobacco
smokers.” J. Periodontol., 42: 259-263, 1971
54.
STOLTEMBERG J.L., OSBORN J.B., PIHLSTROM B.L., HERZBERG M.C., AEPPLI
D.M., WOLFF L.F., E COLL.: “Association between cigarette smoking,
bacterial pathogens, and periodontal status.” J. Periodontal., 64:
1225-1230, 1993
55.
SWEET J.B., BUTLER D.P.: “The relationship of smoking to localized
osteitis.” J. Oral. Surg., 7: 732-735, 1979
56.
TRIKILIS N., RAWILSON A., WALSH T.F.: “ Periodontal probing depht
and subgengival temperature in smokers and non-smokers.” J. Clin.
Periodontol. 1: 38-43, 1999
57.
TROMBELLI L., SCABBIA A.: “Healing response of gingival recession
defects following guided tissue regeneration procedures in smokers and non
smokers.” J. Clin. Periodontol., 8: 529-533, 1997
Articolo
pubblicato su JED Journal of Evolutionary Dentistry
Vol
1, N° 2 Dicembre 1998 http://www.dental-smile.com
Per gentile concessione
dell’editore e direttore responsabile Dott. Mario Lendini