RACCOLTA DEI CAMPIONI
Per quanto riguarda i pazienti non espettoranti si raccomanda di eseguire sempre l'aspirato ipofaringeo che va effettuato dopo la seduta fisioterapica, stimolando il colpo di tosse ed impiegando un sondino sterile da aspirazione con una grossa siringa, il sondino viene successivamente reciso entro una provetta sterile o direttamente in un contenitore con un idoneo terreno di trasporto.
Per quanto riguarda l'esecuzione del tampone faringeo va ricordato che i suoi risultati possono essere fuorvianti, anche se in alcuni casi riflette con una certa fedeltà la flora microbica presente nelle basse vie respiratorie se si ha cura di eseguirlo correttamente stimolando il colpo di tosse (1,2).
Per i pazienti in grado di produrre espettorato, si raccomanda la raccolta previa esecuzione di un lavaggio orale eseguito con acqua e con l'ausilio di uno spazzolino.
Conservazione: Tutti i campioni devono essere immediatamente consegnati al laboratorio, qualora non sia possibile processarli immediatamente si consiglia di conservarli a 4°C.
Qualora vengano ricevuti campioni che hanno soggiornato in frigorifero o a temperatura ambiente per tempi più lunghi (es: campioni ricevuti per posta) è consigliata l' indicazione nel referto delle limitazioni di un esame eseguito su tali campioni .
Data la particolare viscosità delle secrezioni bronchiali dei pazienti FC è sempre consigliabile la fluidificazione dell'espettorato da eseguirsi con omogenizzatori o con l'utilizzo di mucolitici previa separazione della parte più densa del campione (quest'ultimo accorgimento è particolarmente importante per l'esecuzione corretta della conta batterica).
Quale mucolitico di prima scelta è consigliato il Ditiotreitolo, mentre per quanto riguarda l'acetilcisteina anch'essa mucolitico di largo uso, esistono alcune evidenze che indicherebbero una certa sua attività inibente sulla crescita batterica (1).
Periodicità: Le indagini microbiologiche nei pazienti FC devono essere eseguite almeno con cadenza trimestrale o al momento della riacutizzazione.
OSSERVAZIONE MICROSCOPICA
E' consigliato l'esame microscopico dei campioni di espettorato, in quanto oltre a consentire la valutazione dell'idoneità del campione, permette anche l'identificazione presuntiva dei microrganismi presenti (3). Tuttavia per i campioni di espettorato provenienti da pazienti FC non è ritenuta indispensabile, infatti tali pazienti presentano in genere un'espettorazione abbondante e purulenta, già indice di provenienza dalle basse vie respiratorie, che facilmente soddisfa i criteri che definiscono l'idoneità del campione.
CARICA BATTERICA
L'indicazione quantitativa della carica batterica è ritenuta indispensabile per il clinico in quanto indice dell'efficacia della terapia antibiotica, si ritiene tuttavia sufficiente una semplice indicazione semiquantitativa della carica. E' consigliata la tecnica semiquantitativa messa punto dal Centro Danese FC diretto dal Prof. Høiby :
-Diluire il materiale più purulento del campione 1:1(v/v) con Ditiotreitolo, lasciando il campione per 60 minuti a temperatura ambiente o per 30 minuti in termostato a 35-37°C.
-Seminare le piastre usando la tecnica delle "tre zone", depositando 20 µl del campione e strisciare 5 linee avanti e 5 linee indietro per
Vogni quadrante come indicato in figura:
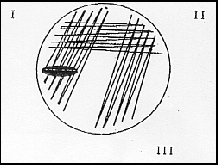
|
B |
||
|
-Quantificare la crescita come indicato nella tabella: |

|
F |
||
TERRENI DI COLTURA
Per un efficace isolamento di tutti i potenziali patogeni sono consigliati i seguenti terreni:
agar MacConkey o analoghi (bacilli gram-negativi)
agar cetrimide ( Pseudomonas spp.).
agar cioccolato con bacitracina (Haemophilus spp. ): L'utilizzo del terreno addizionato con bacitracina è particolarmente raccomandato, in quanto in agar cioccolato semplice l'isolamento di Haemophilus spp è spesso reso impossibile dalla contemporanea crescita di P. aeruginosa.
agar sale mannite (Staphylococcus aureus )
agar sangue (cocchi gram-positivi)
agar Sabouraud (miceti) :L'uso di tale terreno non è da ritenersi routinario, ma può essere limitato ai casi in cui esista una specifica richiesta del clinico.
agar OFPBL (Burkholderia cepacia): E' un terreno selettivo e differenziale indicato in letteratura come uno dei migliori per l'isolamento di Burkholderia cepacia (4). Il suo uso routinario è da ritenersi indispensabile, infatti in mancanza di un terreno selettivo la presenza di tale patogeno sfugge all'osservazione perché la sua crescita piuttosto lenta è coperta da quella di P. aeruginosa.
L'incubazione di tutte le piastre deve essere protratta per due giorni a 35-37°C. Per l'isolamento di microrganismi a lenta crescita (es: Alcaligenes xylosoxidans, B. cepacia) è necessario protrarre l'incubazione del terreno idoneo per tre giorni.
ANAEROBI
Dato che in alcuni casi gli anaerobi possono rivestire un ruolo patogeno nei pazienti FC devono essere ricercati qualora vi sia una specifica richiesta del clinico e soltanto su campioni idonei per tale tipo di indagini.
STAFILOCOCCHI METICILLINO-RESISTENTI
Gli stafilococchi meticillino resistenti sono patogeni nosocomiali isolati con frequenza crescente anche da pazienti FC . Tali microrganismi costituiscono un notevole problema clinico in quanto sono sensibili solo a pochissimi agenti chemioterapici: è quindi di fondamentale importanza effettuare, oltre ad una corretta identificazione, anche una altrettanto corretta valutazione della meticillino resistenza. Tale resistenza può essere valutata con metodi diversi, infatti oltre alle metodiche classiche agar e brodo diluizione, attualmente sono disponibili anche test di screening su piastra e test qualitativi rapidi con lettura in fluorescenza.
E' noto che l'espressione della meticillino resistenza è notevolmente influenzata dalle condizioni con cui il test è eseguito, ed in particolare: il tipo di antibiotico con cui la resistenza è valutata che preferibilmente deve essere oxacillina ad una concentrazione di 6 µg/ml se si utilizzano test di screening su piastra; l'incubazione, che deve essere protratta per 24 h a una temperatura di 30-35 °C; la concentrazione di NaCl che deve essere 2% (w/v) per agar e brodo diluizione e 4% (w/v) per i test di screening su piastra; il terreno di coltura utilizzato che deve essere CAMHB per brodo diluizione, MHA per agar diluizione e test di screening su piastra. Soltanto il rispetto di tutte queste condizioni è infatti in grado di evidenziare la resistenza in tutti i ceppi di stafilococchi (5,6).
Vengono consigliate le piastre "MRSA screen" che sono un esempio di test di screening su piastra, e il più affidabile ma ben più costoso "Crystal MRSA ID" un test qualitativo che avvalendosi di un indicatore fluorescente sensibile all'Ossigeno è in grado di identificare con precisione in 4 ore i ceppi di stafilococchi meticillino resistenti . Entrambi i tipi di test sono commercializzati dalla Ditta Becton Dickinson.
PSEUDOMONAS AERUGINOSA E BURKHOLDERIA CEPACIA
E' noto che i ceppi di Pseudomonas aeruginosa isolati da pazienti FC presentano una notevole variabilità fenotipica (sono stati differenziati fino a 6 morfotipi), e che tali varianti possono manifestare una diversa sensibiltà agli agenti chemioterapici. E' quindi di fondamentale importanza differenziare almeno i due morfotipi "rugoso" e "mucoide" ed eseguire gli antibiogrammi separatamente in quanto ogni morfotipo può presentare una diversa chemiosensibilità. Per quanto riguarda l'identificazione di Pseudomonas aeruginosa e Burkholderia cepacia vengono consigliati i seguenti metodi: il sistema ATB expression, le gallerie API (API 20 NE) entrambi della ditta Biomerieux e il sistema Cristal della Becton Dickinson. L' identificazione di Burkholderia cepacia presenta maggiori difficoltà rispetto a quella di Pseudomonas aeruginosa e si consiglia pertanto di ripetere l'identificazione utilizzando due metodi diversi o di eseguire test biochimici supplementari quali: lisina e ornitina decarbossilasi e liquefazione della gelatina.
VALUTAZIONE DELLA CHEMIOSENSIBILITA'
Gli antibiotici che devono essere inclusi nelle prove di chemiosensibilità per Pseudomonas aeruginosa, Alcaligenes xylosoxidans, Stenotrophomonas maltophilia e Burkholderia cepacia sono indicativamente i seguenti:
AMINOGLICOSIDI ß-LATTAMICI CHINOLONICI
netilmicina imipenem ciprofloxacin cotrimossazolo
tobramicina piperacillina
gentamicina ticarcillina/clavulanato
amikacina ceftazidime
ceftriaxone
aztreonam
cefepime
Su ceppi multiresistenti, da definirsi tali se presentano resistenza a tutti gli agenti di almeno due delle seguenti classi: ß-lattamici (includendo imipenem ed aztreonam), chinolonici (ciprofloxacin), aminoglicosidi (tobramicina), si consiglia di testare anche: meropenem, piperacillina/tazobactam, tetraciclina/cloramfenicolo.
Sui ceppi multiresistenti, al fine di evidenziare il possibile effetto sinergico esistente fra associazioni di antibiotici, si consiglia di testare per la sinergia ( con E test oppure con agar diffusione con associazione di dischetti ) quelle associazioni fra le seguenti, che il clinico ritene più significative:
ticarcillina/clavulanato +tobramicina
piperacillina +tobramicina
ceftazidime +tobramicina
ceftazidime +amikacina
imipenem +tobramicina
imipenem +amikacina
aztreonam +tobramicina
ciprofloxacin +piperacillina
ciprofloxacin +imipenem
STREPTOCOCCUS PNEUMONIAE
Dati recenti riportano in Italia una percentuale di ceppi resistenti alla penicillina G intorno al 5%, si raccomanda pertanto di di saggiare la resistenza alla penicillina di Streptococcus pneumoniae in agar diffusione su MHA supplementato con sangue di montone al 5% con un dischetto di oxacillina da 1mg: i ceppi che presentano una zona di inibizione ³20 mm (MIC £0.06 mg/ml) sono da considerarsi sensibili alla penicillina e a tutte le altre ß-lattamine. Per i ceppi che presentano un alone di inibizione £19 mm è consigliabile la determinazione delle MIC con il metodo della microdiluizione in brodo secondo le direttive del NCCLS.
INDAGINI SIEROLOGICHE
Il monitoraggio dell'infezione da Pseudomonas aeruginosa è di vitale importanza nei pazienti FC in quanto consente di intervenire tempestivamente con una terapia antibiotica mirata.
Il passaggio da una colonizzazione superficiale ad una colonizzazione cronica non è sempre agevole sulla base delle sole evidenze batteriologiche (presenza di Pseudomonas aeruginosa nell'escreato continuativamente per 6 mesi e in almeno 3 colture consecutive). Essendo la fase di infezione in genere accompagnata dalla stimolazione di una specifica risposta anticorpale, la valutazione della presenza di anticorpi circolanti anti-Pseudomonas aeruginosa può costituire un notevole ausilio per evidenziare il passaggio alla fase cronica dell'infezione. Già a partire dal 1976 il Centro danese FC diretto dal Prof. N. Høiby ha utilizzato la crossed-immunoelectrophoresis (CIE) per la valutazione di anticorpi anti-Pseudomonas aeruginosa. E' stato infatti dimostrato che un numero di anticorpi ³ 2 anche in presenza di una colonizzazione intermittente o inferiore a 6 mesi, si associa ad un'infezione cronica da Pseudomonas aeruginosa che necessita di un tempestivo trattamento antibiotico con cicli endovenosi trimestrali (7).
Attualmente ci si può avvalere di metodiche sierologiche diverse per il monitoraggio dell'infezione da Pseudomonas aeruginosa:
CIE : E' una metodica sierologica che presenta un buon potere analitico anche se la sensibilità non è elevatissima, non è molto costosa ma è laboriosa, evidenzia solo anticorpi precipitanti e consente di analizzare contemporaneamente un numero limitato di campioni.
IEOP :(immunoelectro osmophoresis): E' una tecnica elettroforetica simile alla CIE ma di più veloce e semplice esecuzione che ha fornito buoni risultati in termini di sensibilità e specificità (8,9).
ELISA: Consente di evidenziare anticorpi diretti contro antigeni specifici di Pseudomonas aeruginosa, ha una buona specificità e sensibiltà (in genere maggiore di quella delle metodiche elettroforetiche), si presta all'automazione anche se i costi sono maggiori rispetto alle metodiche precedenti. E' utilizzata in alternativa alla CIE in Centri di riferimento per indagini sierologiche di pazienti FC quale quello di Tübingen diretto dal Prof. G. Döring.
IB:(Immunoblotting): Tale metodica consente similmente alla precedente una maggiore flessibilità negli anticorpi evidenziabili , si presta all'automazione anche se è piuttosto costosa e non sempre di facile interpretazione. Anch'essa ha una maggior sensibilità rispetto alle tecniche elettroforetiche e un miglior poter analitico rispetto all'ELISA.
TIPIZZAZIONE INTRASPECIFICA DI PSEUDOMONAS AERUGINOSA E BURKHOLDERIA CEPACIA
Importanza crescente viene attribuita alla tipizzazione di Pseudomonas aeruginosa e Burkholderia
cepacia al fine di chiarire le possibili vie di trasmissione di tali patogeni. Le tecniche maggiormente utilizzate a tale scopo sono: sierotipizzazione, biotipizzazione, tipizzazione piocinica e recentemente tecniche di biologia molecolare che utilizzano markers genetici (es.pulsed field gel electrophoresis, random amplified polymorphic DNA fingerprints). Data la notevole variabilità fenotipica che caratterizza i ceppi isolati da pazienti FC (molti di essi sono poliagglutinabili o non agglutinabili) molti autori consigliano di affiancare una delle tecniche tradizionali con una di quelle che basa il suo potere discriminante su caratteristiche genetiche dei germi in questione ( 10).
MICOBATTERI
Esistono in letteratura molti casi di isolamento di micobatteri da pazienti con FC , recentemente sono aumentate in maniera preoccupante le segnalazioni di micobatteri atipici. Il significato clinico dei micobatteri non tubercolari in tali pazienti è attualmente sconosciuto, tuttavia è importante che vengano isolati ed identificati tempestivamente su richiesta del clinico.
Nei pazienti FC colonizzati da Pseudomonas aeruginosa l'isolamento dei micobatteri presenta notevoli problemi tecnici in quanto tale batterio può sopravvivere alla decontaminazione eseguita con il metodo tradizionale, è quindi consigliabile in questi casi ricorrere all'utilizzo di acido ossalico in aggiunta alla normale decontaminazione come indicato in letteratura (11). L'esame batterioscopico può essere eseguito previa colorazione di Ziehl-Neelsen o con auramina, l'esame colturale è da ritenersi indispensabile infatti la resa dell'esame microscopico è scarsa per quanto riguarda i micobatteri non tubercolari.
Raccolta dei campioni: Sono particolarmente indicati l'aspirato ipofaringeo e l'escreato.
Conservazione: è concessa la conservazione a 4 °C , è opportuno segnalare le limitazioni di esami eseguiti su campioni ricevuti per posta.
Periodicità: esami con cadenza trimestrale o al momento della riacutizzazione.
Trattamento dell'escreato:è necessaria la fluidificazione da eseguirsi meccanicamente tramite omogenizzatori o con mucolitici quali il Ditiotreitolo.
Osservazione microscopica: è consigliata ma ritenuta non indispensabile.
Carica batterica: è sufficiente ma indispensabile l'indicazione semiquantitativa della carica da eseguirsi preferibilmente con la tecnica del Prof Høiby.
Terreni di coltura: si consiglia l'uso routinario dei seguenti terreni: agar MacConkey, agar cioccolato con bacitracina, agar sale mannite, agar sangue, agar OFPBL.
Incubazione: per 2 giorni a 35-37 °C, è necessario prolungare di altre 24 ore l'incubazione dei terreni idonei alla crescita dei gram negativi non fermentanti.
Microrganismi da segnalare: è importante segnalare tutti i microrganismi potenzialmente patogeni per pazienti FC, la segnalazione di microrganismi che rientrano nella definizione di "normale flora" è da effettuarsi a discrezione del microbiologo o su specifiche indicazione cliniche.
Anaerobi: devono essere ricercati su specifica richiesta del clinico e solo su campioni idonei.
Stafilococchi meticillino resistenti: la meticillino resistenza deve essere testata su tutti gli stafilococchi isolati rispettando le indicazioni del NCCLS.
Streptococcus pneumoniae: è necessario testare la resistenza alla penicillina G da eseguirsi in agar diffusione su Mueller Hinton supplementato con sangue di montone al 5% con un dischetto di oxacillina da 1 mg.
Pseudomonas aeruginosa e Burkholderia cepacia: Identificazione: Può essere eseguita sia con metodiche manuali che automatizzate, sono consigliati in particolare: il sistema ATB expression, le gallerie API (Biomerieux) e il sistema Cristal (Becton Dickinson). Per quanto riguarda l'identificazione di Burkholderia cepacia è consigliabile ripeterla utilizzando due metodi diversi ed eventualmente eseguire tests biochimici supplementari (lisina e ornitina decarbossilasi e liquefazione della gelatina).Valutazione della chemiosensibilità: può anch'essa essere testata con metodi manuali o automatizzati, è importante differenziare almeno i due morfotipi "rugoso" e "mucoide" di Pseudomonas aeruginosa e testarne la chemiosensibilità separatamente.
Valutazione della chemiosensibilità: Per Pseudomonas aeruginosa, Alcaligenes xylosoxidans, Stenotrophomonas maltophilia e Burkholderia cepacia si consiglia di testare la chemiosensibilità dei seguenti farmaci: netilmicina, tobramicina, gentamicina, amikacina, imipenem, piperacillina, ticarcillina/clavulanato, ceftazidime, ceftriaxone, aztreonam, cefepime, ciprofloxacin, cotrimossazolo. Su ceppi multiresistenti (resistenti a tutti gli agenti di almeno due delle seguenti classi: ß-lattamici, aminoglicosidi, chinolonici), si consiglia di testare anche: meropenem, piperacillina/tazobactam, tetraciclina/cloramfenicolo. Su tali ceppi deve essere valutata anche l'eventuale sinergia fra associazioni di farmaci.
Tipizzazione intraspecifica : è utile per studi di tipo epidemiologico, a causa della notevole variabilità fenotipica di Pseudomonas aeruginosa e Burkholderia cepacia, si consiglia di affiancare una metodica classica (sierotipizzazione, tipizzazione piocinica, ecc.), con una che utilizza markers genetici (DNA fingerprints).
Indagini sierologiche: Per il monitoraggio dell'infezione polmonare è necessaria la valutazione della risposta anticorpale nei confronti di Pseudomonas aeruginosa che può essere determinata con le seguenti metodiche: crossed-immunoelectrophoresis (CIE), immunoelectro osmophoresis (IEOP), ELISA, Immunoblotting (IB).
Micobacteria spp: Devono essere ricercati su specifica richiesta del clinico, l'esame batterioscopico può essere eseguito previa colorazione di Ziehl-Neelsen o con auramina, ad esso deve sempre seguire l'esame colturale. E' indispensabile eseguire anche la decontaminazione con acido ossalico.