|
Funzioni e localizzazione di
NGF e dei suoi recettori L’NGF è stato scoperto agli inizi degli anni ‘50 da
Viktor Hamburger e dalla sua allieva Rita Levi Montalcini nel tentativo di
identificare e caratterizzare un fattore responsabile del differenziamento in
senso neuronale di cellule totipotenti dei gangli del simpatico e della
midollare del surrene. Essi utilizzarono il veleno del serpente Mocassino
dotato di attività fosfatasica. Aggiungendo il veleno di serpente a queste
cellule, essi riuscirono ad indurre un aumento della sopravvivenza di quelle
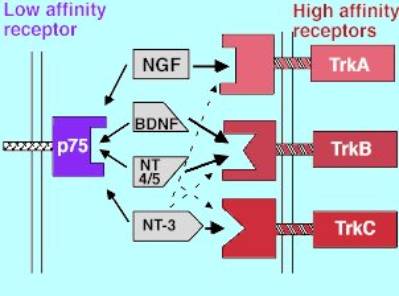
cellule ed una loro differenziazione in senso neuronale. L’NGF fa parte della famiglia delle neurotrofine, insieme al brain derived neurotrophic factor (BDNF) ed alle neurotrofine 3 (NT-3) e 4/5 (NT-4/5). Al pari di NGF, tali neurotrofine controllano la crescita e/o la differenziazione non solo dei neuroni, ma anche di altri tipi di cellule. L’azione di queste neurotrofine è mediata da
specifici recettori ad attività tirosin-chinasica denominati trkA, trkB e
trkC. ogni singola neurotrofina si lega specificamente ad uno di questi e, in
particolare, NGF si lega a trkA, BDNF ed NT-4 a trkB, mentre NT-3 si può
legare a tutti e tre sebbene i suoi effetti biologici sembrino essere mediati
preferenzialmente da trkC (fig.4).
Figura 4 Interazione
delle neurotrofine con i loro recettori Analogamente ad altri recettori per i fattori di
crescita, i recettori per alle neurotrofine condividono una comune struttura
di base, essendo costituiti da una porzione N-terminale extracellulare, da
una singola regione idrofobica che attraversa la membrana plasmatica e da un dominio citoplasmatico, sede
dell’attività catalitica tirosin-chinasica. La maggior parte dei recettori
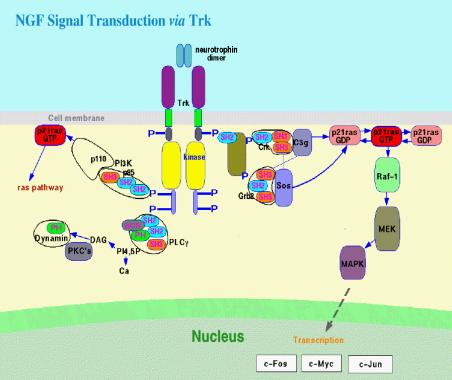
noti è costituita da una singola catena polipeptidica. I recettori sono articolati in cinque domini funzionali: 1) il dominio extracellulare, comprendente il sito di legame ad elevata affinità per il fattore di crescita. E’ formato da alcune centinaia di aminoacidi, contiene numerosi siti di glicosilazione, residui di cisteina e motivi strutturali peculiari. 2) il dominio transmembrana, costituito da circa 25 residui idrofobici che attraversano il doppio strato lipidico; questo dominio è in genere seguito da una serie di residui basici che fungono da segnale di ancoraggio alla membrana. 3) il dominio iuxtamembrana, nella parte citoplasmatica, definito di "transmodulazione" dove avviene la fosforilazione delle tirosine e serine da parte della PKC (regolazione negativa); 4) il dominio catalitico, responsabile dell’attività tirosin-chinasica, formato da circa 250 aminoacidi ed in alcuni casi interrotto da una regione a funzione regolatoria. 5) la coda carbossi-terminale, contenente in media 250 aminoacidi, con lunghezza e funzioni variabili nei vari recettori. E’ il segmento che, nel recettore attivato, lega i trasduttori intracellulari del segnale (47). In seguito al legame tra NGF e trkANGFR, il recettore viene attivato tramite un meccanismo, comune a tutti i recettori tirosin-chinasici, che ha inizio a livello del sito di legame e che prosegue con la omo- o etero-dimerizzazione di due molecole recettoriali, l'attivazione dell'attività catalitica seguita dall'autofosforilazione crociata in cui la chinasi di un recettore del dimero fosforila la tirosina del recettore adiacente con la formazione di fosfotirosine e quindi l'interazione delle fosfotirosine con i trasduttori del segnale, proteine intracellulari che presentano il dominio SH2 nella loro struttura (fig.5). Al legame recettore-trasduttore seguono diversi eventi: 1) reclutamento del trasduttore alla membrana plasmatica e sua interazione con eventuali substrati ad essa associati; 2) interazione del trasduttore con il dominio catalitico del recettore per la fosforilazione della tirosina; 3) modificazioni conformazionali del trasduttore, anche indipendenti dalla fosforilazione, che ne modulano l’attività. Esistono due classi di trasduttori provvisti di dominio SH2. La prima comprende proteine che hanno un’attività enzimatica propria quali: la fosfolipasi C-g, la tirosin chinasi citoplasmatica codificata dal proto-oncogene c-SRC (pp60src), le fosfotirosina-fosfatasi SH-PTP1 e SH-PTP2, l’attivatore delle GTP-asi (GAP), lo scambiatore GDP/GTP codificato dall’oncogene vav. Fanno parte della seconda classe i trasduttori contenenti il dominio SH2 ma che sono privi di attività catalitica intrinseca; questi fungono da subunità regolatrici di molecole enzimatiche citoplasmatiche (48).
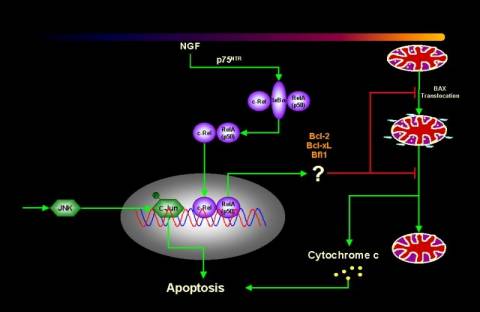
Figura 5 Trasduzione del segnale in seguito al legame NGF-trkANGFR Il recettore trkANGFR presenta diverse localizzazioni subcellulari che sembrano essere associate a differenti risposte biologiche all'NGF. E' stato ipotizzato che la localizzazione transmembrana di trkANGFR potrebbe essere legata ai processi di proliferazione e sopravvivenza mentre quella intracellulare potrebbe in parte essere responsabile dei meccanismi correlati alla differenziazione. Accanto al recettore trkANGFR di 140 kD, esiste un altro recettore, di 75 kD, con diversa affinità, denominato p75NTR, capace di legare tutte le neurotrofine, che si comporta da modulatore del segnale di trkANGFR aumentandone l'affinità e la selettività nei confronti di NGF. p75NTR fa parte della superfamiglia dei recettori TNF/NGF e quindi contiene la sequenza "death domain" nella sua regione citoplasmatica. La presenza di questo dominio indurrebbe ad ipotizzare un suo possibile ruolo nella mediazione dell'apoptosi, ruolo tuttavia ancora molto poco chiaro in quanto, dal punto di vista biologico, p75NTR mostra sia un comportamento proapoptotico che antiapoptotico (46).
Figura 6 Trasduzione del segnale in seguito al legame NGF- p75NTR |