La termodinamica classica studia il comportamento dei corpi in relazione al calore, senza indagare cosa avvienga all'interno dei corpi stessi durante le trasformazioni. La teoria cinetica, invece, dei gas parte dall'ipotesi della costituzione molecolare della materia e cerca di spiegare i fenomeni termici con il movimento delle molecole. Le molecole di una sostanza qualsiasi, che si trovino ad una certa temperatura, sono in continuo movimento, detto moto di agitazione termica. Ciò significa che ciascuna molecola è dotata di un Energia Cinetica (ec). Le molecole interagiscono tra loro con forze, che sono repulsive a piccole distanse e attrattive a grandi distanze. Per tali forze si può definire, come per qualsiasi altra forza che si esercita tra due corpi e che dipenda solamente dalla loro distanza, un Ep e un Ep(r) r = distanza.
Un corpo è costituito da un numero elevatissimo di molecole, quindi per ciascuna di loro si può definire un "ep" corrispondente alla sua interazione ad una molecola presa come riferimento. Si definisce energia potenziale complessiva "Ep" la somma ep che competono alle forze d'interazione della molecola presa come riferimento con tutte le altre a lei circostante.
Per ogni molecola si può definire un'energia meccanica "e" pari alla somma del ec e del ep, così da avere:
e = ec + ep
Da questo punto di vista la differenza tra un gas perfetto ed un gas reale è molto semplice: nel primo le forze d'interazione sono così deboli che l'energia potenziale di ciascuna molecola può essere trascurata rispetto all'energia cinetica e la sua energia totale si riduce quindi alla sola energia cinetica; nel secondo invece, il valore assoluto dell'energia potenziale è piccolo ma non trascurabile rispetto all'energia cinetica. In un gas perfetto ciascuna molecola, non essendo soggetta a forze da parte delle altre molecole, si muovono di moto rettilineo uniforme fino a quando urtano contro una parete del recipiente in cui il gas è contenuto. Quest'urto può essere descritto come un urto elastico, vale a dire un urto nel quale la molecola rimbalza conservando la stessa energia cinetica, in valore assoluto, ma con verso cotrario. In un gas reale, invece, oltre che contro le pareti, le molecole si urtano anche tra di loro, quindi ogni volta che una molecola, durante il suo moto, passa nella sfera d'azione di un'altra, la sua traiettoria subisce una deviazione simile a quella subita da una palla da biliardo che urta contro una palla ovale. Nel definire le leggi dei gas, abbiamo preso in considerazione le tre grandezze fondamentali dei gas P, V, T, e in questo caso il punto di vista termodinamico si dice macroscopico. Il punto di vista della teoria cinetica molecolare, che analizza le grandezze dinamiche delle singole molecole, si dice microscopico. La teoria cinetica molecolare parte da ipotesi non controllabili direttamente, in quanto non è possibile vedere i moti delle molecole. Essa propone, dunque, un modello, una costruzione che non è la fotografia della realtà, ma un mezzo per interpretarla.
·Le ipotesi, su cui si basa la teoria cinetica molecolare, sono le seguenti:
1) i gas sono costituiti da particelle, le molecole, che sono molto numerose e simili a piccole sfere;
2) le molecole hanno un moto continuo e disordinato, tale moto è del tutto casuale, in altre parole si svolge indifferentemente in ogni direzione e non esiste alcuna preferenziale;
3) il moto delle particelle obedisce alle leggi della dinamica e gli urti sono completamente elastici;
4) il volume delle molecole è molto piccolo rispetto alle reciproche distanze, le forze d'interazione tra le molecole sono trascurabili e si manifestano solo dopo gli urti.
INTERPRETAZIONE CINETICA DELLA PRESSIONE
La legge di Gay-Lussac ci permette di affermare che una massa di gas racchiusa in un recipiente ha una pressione diversa per ogni temperatura. Questa pressione si manifesta, a livello macroscopico, come una forza che agisce sul liquido del manometro ed è sempre la stessa in ogni punto, ciò significa che il gas esercita una pressione su tutti i punti delle pareti del recipiente, che lo contiene con euguale intensità. Vediamo ora di capire che cos'è la pressione di un gas, dal punto di vista microscopico. Nel movimento disordinato le molecole del gas rimbalzano le une contro le altre e contro le pareti del recipiente; perciò la pressione non è altro che la forza meccanica prodotta dagli urti delle molecole contro la superficie delle pareti del recipiente, cioè:
Prendiamo in considerazione un recipiente cubico di lato "a" e volume "V" secondo gli assi cartesiani x, y, z in cui vi sono N (n°) molecole di gas perfetto; ci chiediamo quale sia la pressione P esercitata dal gas sulle pareti del recipiente che lo contiene, pressione dovuta ai nomerosi urti, e come si possa calcolare questa pressione in base alla teoria cinetica della meteria, cioè applicando al moto delle molecole del gas, ciò che si è appreso dallo studio della dinamica del punto materiale. Da ogni punto sulle faccie del cubo si verifica una determinata variazione totale di quantità di moto; si deve quindi calcolare la variazione totale della quantità di moto di tutte le molecole che rimbalzano nell'unità di tempo sulle facce del cubo S e uguagliare questa variazione alla forza che si esercita su ogni faccia. Il calcolo è alquanto laborioso, inquanto le molecole colpiscono le facce del cubo sotto differenti angoli e con diverse velocità. Tuttavia si giunge ad un risultato esatto se, per semplificare il ragionamento e i calcoli, si sostituisce il movimento caotico delle molecole con un movimento ordinato, ossia se si suppone che tutte le molecole abbiano la stessa velocità, e che il loro moto avvenga secondo tre direzioni ortogonali, di modo che 1/6 di loro si muova perpendicolarmente ad una faccia del cubo, 1/6 nel senzo contrario e le rimanenti si muovano secondo le quattro direzioni restani parallelamente a tale faccia del cubo. In queste condizioni ogni molecola di massa "m", urtando perpendicolarmente la parete, subisce una variazione di quantità di moto:
Dq = q2 - q1 = -mv -(mv) = -2mv;
Dq = -2mv · (N/6).
(teorema dell'impulzo F · t = q2 - q1)
F = Dq/t = -2mv · (N/6) · 1/t = -(Nmv)/3t
F = Dq/t = -2mv · (N/6) · 1/t = -(Nmv)/3t
P = F/S = [(Nmv)/3t] · 1/S
t = S/v
t = a/v
t = a/v
P = [(Nmv)/3t] · 1/S = (N/3) · [(m · v)/(a/v)] · 1/S = (N/3) · [(m · v²)/(a · S)] = (N/3) · [(m · v²)/V]
P = (1/3) · nmv²
P = (2/3) · n · [(mv²)]/2
ENERGIA CINETICA E TEMPERATURA ASSOLUTA
Riprendiamo in considerazione (m/V) · Nv² e scriviamola nella formula P · V = (1/3) · Nmv² moltiplichiamo ambo i per 3/2, si ottiene:
(3/2) · P · V = ½ · Nmv² (1)
il numero N di molecole contenute in n moli di gas è: N = n · N0 (3)
dove N0 è un numero fisso detto di AVOGADRO, N0 = 6,02 · 1023 molecole/moli
ed è il numero di molecole per ogni mole di gas. Tenendo conto delle espressioni (2) e (3) la (1), riferita ad una sola mole, divanta:
½ · N0 · mv² = (3/2) · RT
½ · mv² = (3/2) · (R/N0) · T
½ · mv² = (3/2) · KT
K = 1,38 · 10 -23 J/moli °K
K = 1,38 · 10 -23 J/moli °K
ATTENZIONE: in questa trattazione ho utilizzato impropriamente la simbologia "°K" per indicare i gradi Kelvin, per non confondere "K" con una qualsiasi costante.
MOTI BROWNIANI
Il fenomeno, noto come moto browniano, fornisce una prova del moto caotioco delle molecole e ne è quasi la riproduzione in scala viosibile, esso conferma l'estenzibilità della teoria cinetica ai liquidi. Nel 1828 il botanico Brown, esaminando al microscopio una goccia d'acqua, osservò che alcuni granellini di polline si muovevano a traiettori a zig-zag in maniera irregolare e occasionale come fossero dotati di vita. Successive esperienze convinsero Brown che non si trattava di movimenti attivi di esseri viventi, constato che qualsiasi corpo inanimato, sufficientemente piccolo, sospeso in acqua, acquistava un moto molto simile a quello del polline, unica condizione era la piccolezza dei granellini. Questo fenomeno rimase inspiegato fin quando, con la scoperta della teoria cinetica molecolare, si comprese che esso era dovuto agli urti che i granellini subiscono da parte delle molecole del liquido.
Poiché, in generale, l'impulzo che il granulo riceve dalle molecole che lo colpiscono da un lato, è un po' diverso da quello che lo imprimono dal lato opposto, il granulo è spinto di qua e di là, eseguendo quel movimento irregolare che viene osservato.
Alcuni accenni storici sui moti browniani.
Il capo dell'opposizione alla teoria atomica era Wilhelm Ostwald, generalmente ritenuto il «padre della chimica fisica». Egli era un convinto assertore del principio della conservazione dell'energia e considerava l'energia come la realtà fondamentale. Ostwald sosteneva che la trattazione termodinamica di un processo era sufficiente a determinare i suoi parametri essenziali e che ulteriori ipotesi meccaniche sui meccanismi di reazione erano soltanto ipotesi non provate. Egli ripudiò le teorie atomiche e molecolari e lottò per liberare la scienza da "concetti ipotetici che non portano a conclusioni immediate e non sono verificabili sperimentalmente". Ma anche altri eminenti scienziati erano riluttanti ad accettare l'esistenza degli atomi come fatto scientifico assodato.
Ludwig Boltzmann prese posizione contro questo atteggiamento in un articolo del 1897 in cui sottolineò la necessità dell'atomismo nelle scienze naturali. Il progresso della scienza è spesso guidato dalle analogie tra i processi naturali che vengono in mente agli scienziati. La teoria cinetica rappresenta una di queste analogie meccaniche. Come la maggior parte delle analogie, essa suggerisce degli esperimenti per verificare le intuizioni e inoltre spinge a ulteriori investigazioni e conoscenze.
Come sempre succede in queste controversie scientifiche, la risposta definitiva è stata data dagli esperimenti. La prima e più diretta evidenza sperimentale dell'esistenza degli atomi fu la dimostrazione della teoria cinetica atomica fornita dagli studi quantitativi sul moto browniano. Queste osservazioni convinsero sia Mach che Ostwald della validità della teoria cinetica e della descrizione atomica della materia. La teoria atomica venne universalmente accettata negli anni successivi quando un gran numero di esperimenti portò alla determinazione dei valori delle costanti atomiche fondamentali.
Il moto browniano prende il nome dal botanico inglese Robert Brown che, nel 1827, scoprì che un grano di polline sospeso nell'acqua, osservato al microscopio, mostra un moto casuale continuo. Inizialmente questo tipo di moto venne interpretato come una forma di vita. in seguito, però, si vide che anche piccole particelle inorganiche si comportavano allo stesso modo. Fino alla formulazione della teoria cinetica non ci fu alcuna spiegazione quantitativa di questo fenomeno.
Poi, nel 1905. Albert Einstein sviluppò la teoria dei moto browniano. (La teoria di Einstein del moto browniano apparve in un articolo dello stesso volume degli «Annalen der Physik» che conteneva anche il famoso articolo sulla relatività ristretta e anche l'articolo sulla teoria dell'effetto fotoelettrico). Nelle sue Noie autobiografìche Einstein scrive: "In questo il mio obiettivo principale era di trovare fatti che avrebbero garantito il più possibile l'esistenza di atomi di dimensione finita. Nel fare questo scoprii che, in accordo con la teoria atomistica, avrebbe dovuto essere possibile l'osservazione del movimento di particelle microscopiche sospese, senza sapere che quell'osservazione, che riguardava il moto browniano, era nota da molto tempo".
L'ipotesi di fondo di Einstein era che le particelle sospese in un liquido o in un gas partecipano al moto termico dei mezzo e che, in accordo col principio di equipartizione dell'energia, in media l'energia cinetica traslazionale di ogni particella è uguale a (3/2)kT. Secondo questa visione, il moto browniano deriva dagli urti con le molecole del fluido e le particelle sospese acquistano la stessa energìa cinetica media delle molecole del fluido. (Si ricordi che la distribuzione dell'energia di Maxwell-Boltzmann è indipendente dalla massa delle particelle ed e determinata solo dalla temperatura).
Le particelle sospese sono molto più grandi delle molecole dei fluido che le bombardano continuamente da tutte le parti. Se le particelle sono sufficientemente grandi, tale è anche il numero di molecole: quindi, in ogni istante, esse colpiscono le particelle da tutte le parti in modo praticamente uniforme. Se le particelle sono più piccole e quindi in numero di molecole è minore, esse, pur urtando in ogni istante la particella a caso, non colpiscono le sue varie parti in modo uniforme per cui essa non viene più sollecitata allo stesso modo in tutte direzioni: ciò è essenzialmente dovuto al fatto che, a causa del più basso numero di molecole, le fluttuazioni risultano essere più grandi.
Perciò, in ogni istante, la particella è soggetta a una forza non bilanciata che la spinge a muoversi ora in una direzione ora in un'altra. Di conseguenza le particelle si comportano nel fluido come grandi molecole. con un moto qualitativamente simile a quello delle molecole del fluido. Se il numero di Avogadro fosse infinito, non ci sarebbe squilibrio statistico (le fluttuazioni) e quindi non ci sarebbe moto browniano. Se il numero di Avogadro fosse molto piccolo il moto browniano sarebbe molto grande. Dovremmo perciò essere in grado di dedurre il valore del numero di Avogadro partendo dall'osservazione del moto browniano. In questa raffigurazione e profondamente radicata l'idea del moto molecolare, come pure quella delle picco le dimensioni delle molecole. Il moto browniano offre quindi un'importante evidenza sperimentale alle ipotesi che stanno alla base della teoria cinetica.
Senza il bombardamento molecolare, le particelle sospese e sottoposte alla forza di gravita si porterebbero al fondo del recipiente. Dal momento che le particelle sospese si comportano come molecole di gas, la loro densità diminuisce esponenzialmente con l'altezza nel fluido come le molecole nell'atmosfera: esse formano una «atmosfera in miniatura». Il chimico-fisico francese Jean Perrin confermò questa previsione nel 1908 determinando il numero di piccole particelle di resina di gomma sospese a varie altezze in una goccia di liquido (fig. 2a). Dai suoi dati egli dedusse un valore del numero di Avogadro N[a] = 6 x l0^23 particelle/mole. Perrin misurò inoltre gli spostamenti di particelle in moto browniano durante molti intervalli di tempo uguali e trovò che essi seguono la distribuzione statistica richiesta dalla teoria cinetica e che hanno lo spostamento quadratico medio predetto dalia teoria di Einstein (fig. 2b). Per il suo lavoro, che rappresenta una delle prime evidenze dell'esistenza degli atomi, nel 1926 Perrin fu insignito del premio Nobel. Oggi abbiamo evidenze fotografiche molto più dirette(fig. 1).

[Figura 1] Usando un microscopio Tunneling a scansione i fisici delI'lBM hanno scritto, nel 1990. il nome della loro compagnia utilizzando atomi dì xenon.
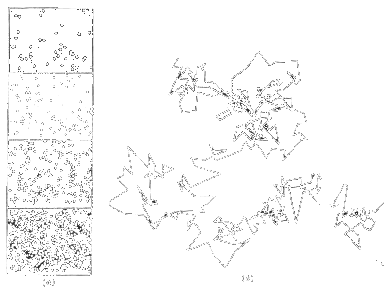
[Figura 2] (a) Rappresentazione di parlicene in gomma resinosi. ottenuta da Perrin nel 1909. Le linee orizzontali rappresentano strati di spessore 0.01 cm e le particelle hanno un diametro di 0.6 x 10^-3 cm. (b) Moto di una minuscola particella in sospensione in acqua, visto attraverso il microscopio. I segmenti corti collegano la sua posizione a intervalli di 30 s. Il percorso della particella costituisce un esempio di un fruttale, una curva per la quale ogni piccola sezione riproduce l'intera curva. Per esempio, se si prende un segmento (30 s) e lo si divide in intervalli più piccoli (per esempio 0.1 s), il nuovo grafico del moto e simile all'intera figura.
TORNA SU
TORNA SU
TORNA SU
e-mail:
Quintiliani Roberto