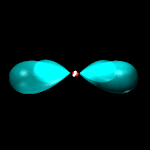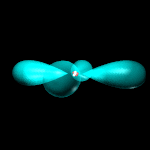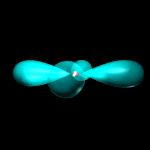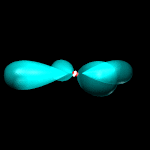|
Orbitale s: orbitale sferico con numero quantico L = 0 e m = 0.
|
|
 |
Orbitali p: 3 orbitali a doppio lobo con numero quantico L = 1 ed m = -1, 0, +1.
|
|
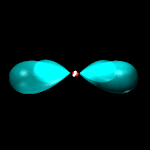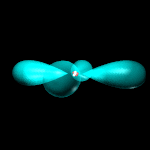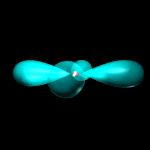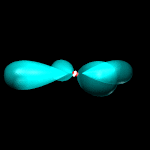
|
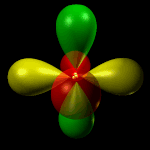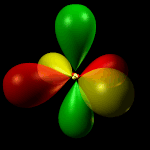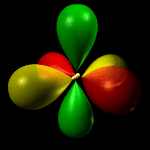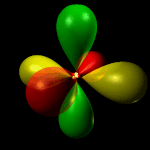
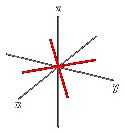
Orbitale dxy: orbitale a quattro lobi giacente sul piano XY, con numero quantico L = 2 e m = -2.
|

|
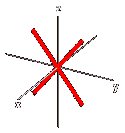
Orbitale dyz: orbitale a quattro lobi giacente sul piano YZ, con numero quantico L = 2 e m = -1.
|

|
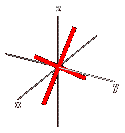
Orbitale dxz: orbitale a quattro lobi giacente sul piano XZ, con numero quantico L = 2 e m = 0.
|

|
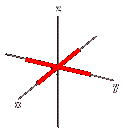
Orbitale dx2y2: orbitale a quattro lobi giacente sul piano e sugli assi XY, con numero quantico L = 2 e m = +1.
|

|
Orbitale dz2: orbitale a due lobi con ciambella giacente sull'asse Z, con numero quantico L = 2 e m = +2.
|

|
Nel complesso l'atomo dovrebbe apparire in questo modo.
|
| N.B. : come simbolo del
secondo numero quantico è stata utilizzata la L maiuscola per
motivi di leggibilità. |