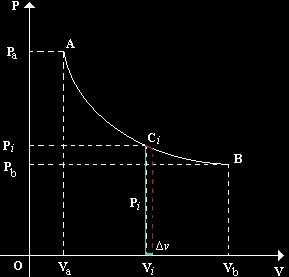
Dv = cambiamento di volume
Dx > 0, lim => 0
| Cambiamenti di stato | Passaggio dallo stato | Allo stato |
| Fusione | Solido ===> | Liquido |
| Solidificazione | Liquido ===> | Solido |
| Evaporazione | Liquido ===> | (Ebollizione) Aeriforme |
| Condenzazione | Vapore ===> | Liquido |
| Sublimazione | Solido ===> | Aeriforme |
| Brinamento | Aeriforme ===> | Solido |
 |
Ci = punto inermedio Dv = cambiamento di volume Dx > 0, lim => 0 |
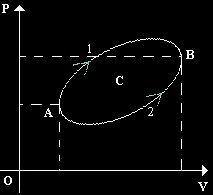
 Tale trasformazione
è costituita dall'arco[1], che va da "A" a "B", e dall'arco[2], che va nel senso
contrario.
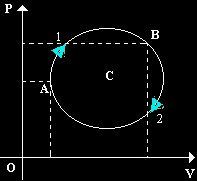
Tale trasformazione
è costituita dall'arco[1], che va da "A" a "B", e dall'arco[2], che va nel senso
contrario. Consideriamo un
sistema che si trovi in uno stato "A" e supponiamo di doverlo portare allo stato
"B"; per fare ciò si possono eseguire infinite trasformazioni, tra cui ci sono
(le qui rappresentate): "ACB"- "ADB"- f- g- h.
Consideriamo un
sistema che si trovi in uno stato "A" e supponiamo di doverlo portare allo stato
"B"; per fare ciò si possono eseguire infinite trasformazioni, tra cui ci sono
(le qui rappresentate): "ACB"- "ADB"- f- g- h.