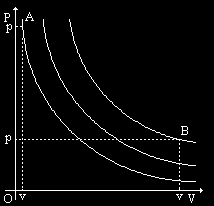
LEGGE DI BOYLE:
ISOTERMA (temperatura costante)
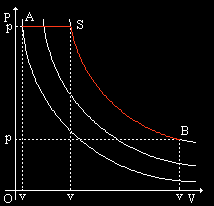
LEGGE DI GAY-LUSSAC:
ISOCORA (volumecostante)
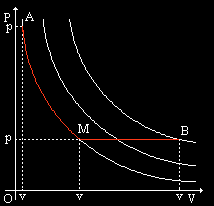
LEGGE DI CHARLES:
ISOBARA (pressione costante)

LEGGE DI BOYLE:
|

|
|
|
|
|
|
|
|
|
 |
 |
|
cioè |
cioè Cv = DU |