|
|
|
|
|
|
|
|
|
|
EQUIVALENZA FRA LAVORO E CALORE
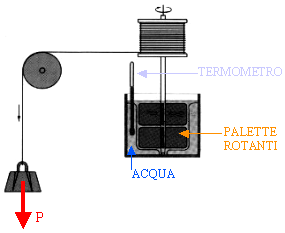
FIGURA TRATTA DAL SITO http://www.geocities.com/Athens/Acropolis/6914/termod.htm
Schema del celebre esperimento col quale Joule trasformò energia meccanica in calore. Il peso scendendo fa girare le palette immerse in un recipiente pieno di acqua. La temperatura dell'acqua aumenta a causa dell'attrito. Paragonando il lavoro eseguito dalla discesa del peso con l'aumento di temperatura dell'acqua, Joule ricavò il valore dell' equivalente meccanico del calore.
Il testo riportato qui sopra è quello originale che accompagna la figura. E' bene fare qualche precisazione.
A) fra acqua e palette in movimento non c'è attrito ma resistenza del mezzo (vedi il mio articolo ATTRITO E LUBRIFICAZIONE).
B) il movimento delle palette produce un aumento dell'energia cinetica delle molecole di acqua e la temperatura aumenta proprio perché essa è proporzionale all'energia cinetica.
C) per ottenere un risultato corretto occorre tener conto di: 1) energia persa per effetto della resistenza dell'aria; 2) lavoro e quindi calore assorbito dalla carrucola e dal fuso che porta la funicella; 3) calore assorbito dal termometro; 4) calore disperso dall'acqua verso l'aria e verso le pareti del recipiente; 5) calore sottratto dal vapore che si sviluppa dall'acqua.
Da tutto ciò segue che questo esperimento fatto in casa non porta a risultati soddisfacenti(*). Per ottenere buoni risultati occorrono materiali, metodi e persone adatti.
Il merito di Joule fu quello di capire l'equivalenza in un periodo di tempo nel quale il calore era ancora un oggetto quasi sconosciuto. Il risultato di tale equivalenza è:
1 [Cal] = 427 [kg x m / s] = 4.186 [J]
La Cal (ovvero Kcal) a sua volta è il calore necessario a portare la temperatura di 1 litro di acqua distillata alla pressione di 1 atmosfera da 15,5 a 16,5 °C. Potremo quindi concludere che, se tutto il lavoro si trasformasse in calore nell'acqua, facendo cadere un peso di 427 kg dall'altezza di 1 metro, 1 kg di acqua nelle condizioni dette aumenterebbe la propria temperatura da 15,5 a 16,5 °C.
Tenendo conto della equivalenza fra kg peso e Newton, nel sistema internazionale si giunge a dire 1 [Cal] = 4.186 [J].
(*) anzi, l'esperienza casalinga porta a un risultato opposto, cioè agitando un liquido caldo se ne ottiene la diminuzione di temperatura!
Rimescolando la minestra calda infatti si favorisce l'uscita del vapore imprigionato nella massa e il contatto con l'aria a temperatura minore. Entrambe le operazioni favoriscono la sottrazione di calore.