|
|
|
|
|
|
|
|
|
DEFINIZIONE: è un processo chimico che trasforma i metalli, per esempio in ossidi solubili, distruggendoli.
CLASSIFICAZIONE: la corrosione può classificarsi in due grandi categorie: 1) chimica; 2) elettrochimica.
1) corrosione chimica: si verifica a causa del contatto fra il metallo e un reagente (acido, base, sale) oppure un agente atmosferico (ossigeno, anidride carbonica, vapore, umidità) oppure ancora un agente disciolto(a) nell'acqua o nell'aria.
La velocità della corrosione dipende da diversi fattori, che possono essere separati o peggio presenti insieme: la temperatura, la pressione, il tipo di agente, lo stato superficiale del metallo(b). Vediamo alcuni casi di corrosione provocata da gas presenti nell'aria:
a) ossigeno O2: attacca facilmente il ferro, di più ad alta temperatura, ma anche a quella ambiente, formando ossidi come Fe3 O4 che sono solubili, oppure formano croste asportabili. Però con alcuni metalli (rame, allumino, ecc.) l'ossigeno forma degli ossidi perfettamente aderenti al metallo, proteggendolo da altri attacchi (passivazione del metallo). Questa proprietà è largamente adoperata nell'industria e negli impianti adoperando particolari sostanze "passivanti".
b) idrogeno H2: penetra fra i cristalli dell'acciaio combinandosi con il carbonio della lega(c). L'idrogeno penetrato nell'acciaio si combina con il carbonio formando metano (C H4) che, essendo gassoso, si libera nell'atmosfera, sottraendo il carbonio all'acciaio. Questo si indebolisce e ciò può portare alla rottura o addirittura alla esplosione se nel recipiente fatto di acciaio c'è una grande pressione (è il caso delle caldaie e dei tubi delle centrali termoelettriche).
c) vapore d'acqua H2 O: a temperature superiori a 400 °C, il vapore(d) si scinde in idrogeno e ossigeno, il quale agisce come si è detto al punto a).
d) anidride solforosa S O2: lo zolfo è presente in quasi tutti i combustibili solidi e liquidi naturali, e quindi durante la combustione si formano diverse anidridi, fra le quali la solforosa; nella combustione si forma però anche vapor d'acqua, la quale, combinandosi con l'anidride solforosa produce l'acido solforoso H2 S O3 che è fortemente aggressivo nei confronti dell'acciaio (gli oggetti si coprono di buchi).
2) corrosione elettro - chimica: tutti i metalli hanno un potenziale elettrico(e), diverso da materiale a materiale. Quando due metalli sono a contatto oppure sono immersi in un liquido elettrolitico(f) fra di loro si sviluppa una differenza di potenziale che provoca una migrazione di ioni da una parte all'altra(g). Lo stesso processo può avvenire però anche su un solo metallo quando l'oggetto presenta delle differenze di struttura (per esempio delle fessure o delle disomogeneità o è sottoposto ad uno sforzo oppure ad un altro). Esempi:
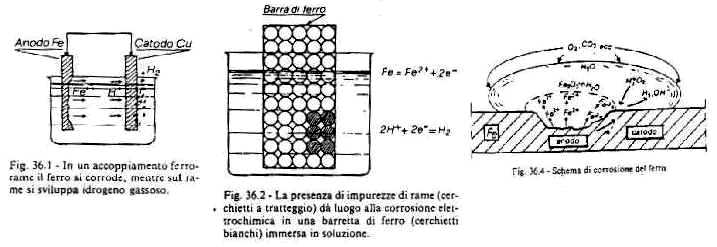
a) ferro - rame: il potenziale del ferro è -0,44 [V] mentre per il rame è +0,34 [V], e quindi il ferro si corrode (passa in soluzione, si "scioglie") mentre intorno al rame si sviluppa idrogeno che si libera nell'aria (si può anche raccoglierlo).
b) ferro con impurezze: la zona dove ci sono le impurezze si comportano da anodo (zona con carica positiva) e si corrodono, mentre le zone più pure fungono da catodo (zona con carica negativa) e restano integre. Come se fossero impurezze si comportano le zone piegate o sottoposte a trazione e compressione, ecc.
c) ferro e acqua: se sulla superficie del ferro si deposita una goccia d'acqua contenente un inquinante, la parte bagnata si comporta da anodo e si corrode.
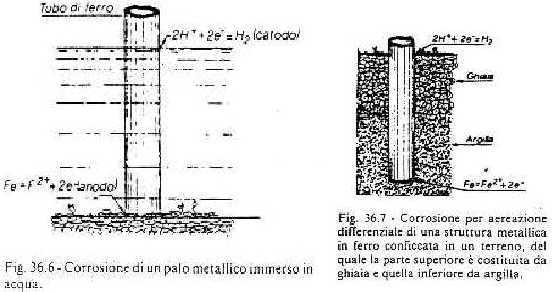
d) palo immerso nell'acqua: nella parte più superficiale c'è più ossigeno e si comporta da catodo; nella parte più profonda c'è meno ossigeno e si comporta da anodo, corrodendosi.
e) palo piantato in un terreno stratificato: nella zona pietrosa c'è più ossigeno, in quella profonda (argillosa) di meno: il palo si corrode in basso.
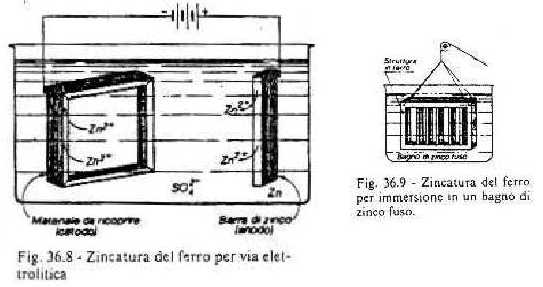
PROTEZIONE: i metodi di protezione principali sono la passivazione, la verniciatura e il rivestimento con materie plastiche o con altri metalli. In tutti i casi la prima operazione da compiere è una perfetta pulizia con appositi detergenti (decapaggio).
Nelle figure sono rappresentati due schemi di rivestimento con zinco di oggetti in ferro. La stessa operazione si può eseguire con lo stagno, l'oro, il rame, ecc.
CORROSIONE SULLE NAVI: sulle navi sono presenti tutti gli agenti chimici e tutte le situazioni descritte sommariamente: liquidi corrosivi, liquidi elettrolitici, correnti elettriche, vapori, ecc. Da qui segue la necessità di operazioni continue di protezione dei metalli, a cominciare dall'acciaio dello scafo. La manutenzione più usuale è quella della verniciatura, con prodotti diversi fra le parti interne, esterne ed immerse. Ma c'è anche una protezione "automatica": lo zinco. Lo zinco ha un potenziale elettrico minore di quello del ferro: ponendone un blocco nelle stesse condizioni del ferro, esso si corrode e il ferro resta integro.
(a) Gli agenti disciolti possono essere naturali (i diversi sali nell'acqua di mare) oppure di origine artificiale (gli inquinanti industriali o civili nell'aria, anche sotto forma di polveri).
(b) La protezione della superficie, per esempio con la verniciatura, è il primo e il più "semplice" modo di allontanare la corrosione. Tuttavia essa non è sempre di facile e ottima realizzazione, perchè non può contrastare tutti i tipi di corrosione nè prevedere tutte le situazioni (basta un graffio per innescare la ruggine!).
(c) L'acciaio è una lega fra ferro e carbonio. Il carbonio è sempre in piccolissima percentuale e si trova in due stati: forma con il ferro un composto Fe3 C detto cementite, oppure è "libero" fra gli atomi del ferro: questo è più facilmente aggredibile.
(d) A questa temperatura è più corretto dire "gas d'acqua": la temperatura di 374 °C (temperatura critica dell'acqua) separa l'aeriforme detto vapore dall'aeriforme detto gas. Per ogni liquido esiste una precisa temperatura critica: per esempio azoto -147, ossigeno -119, mercurio 1.450, elio -268, anidride solforosa 157 °C, ecc.
(e) Il potenziale dipende essenzialmente dalla "tendenza" degli atomi a ricevere o a rilasciare elettroni, e quindi dalla forza che lega gli elettroni al nucleo (forza elettro-debole).
(f) Un liquido si dice elettrolitico quando contiene ioni: il liquido contenuto negli accumulatori delle automobili è una soluzione di acqua e acido solforico (H2 S O4) al 3 %. L'acido nell'acqua si scompone in H2++ con due cariche positive e S O4-- con due cariche negative
(g) E' ciò che accade negli accumulatori elettrici, comunemente detti pile [perchè Alessandro Volta ottenne il primo generatore mettendo uno sull'altro (in pila) dischi di rame e di zinco separati da panni bagnati con acqua e sale] oppure batterie [perchè le diverse celle generatrici sono collegate (in batteria) fra loro].
(h)