|
|
|
|
|
|
|
|
|
|
Le tre T del titolo significano: Temperatura, Tempo, Trasformazione e rappresentano le principali coordinate per le trasformazioni di stato. Si chiamano trasformazioni di stato quei cambiamenti di "forma" della materia indicate con fusione, vaporizzazione, condensazione e solidificazione. Il diagramma si costruisce partendo dallo stato solido di una certa massa di un certo materiale, fornendo calore e studiando cosa accade man mano che la temperatura cresce.
DISPOSITIVO SPERIMENTALE. L'esposizione del diagramma sarà condotta secondo le seguenti condizioni:
1) materiale ferro puro(1);
2) pentolino con coperchio ermetico resistente a qualunque temperatura;
3) fornello capace di raggiungere qualunque temperatura;
4) strumenti di misura senza limiti di portata;
ESECUZIONE DELL'ESPERIMENTO. Mettiamo il ferro nel pentolino e lo chiudiamo. La temperatura sia di 20 °C e la pressione di 1 atm. Mettiamo in moto il cronometro e accendiamo il fornello. Il termometro mostra che la temperatura cresce al trascorrere del tempo per un certo periodo, dopo di che si arresta (diagramma rosso).
Quanto tempo impiega la temperatura a salire? Quanto tempo resta ferma? Il tempo dipende dalla portata di calore e quindi dalla grandezza e dalla forma del fornello, dalla temperatura della fiamma, dal calore specifico del materiale dentro il pentolino, ecc. In ogni caso la pendenza del diagramma (angolo fra il diagramma e l'asse dei tempi) ci da un'idea della velocità del riscaldamento del ferro. Così pure accade per la lunghezza del tratto orizzontale.
Durante il tempo che la temperatura resta costante avviene il primo passaggio di stato: la fusione, cioè la trasformazione da solido a liquido. I legami atomici del reticolo cristallino si rompono e ad essi si sostituiscono, se il materiale non è monoatomico, i legami molecolari.
Terminata la fusione, la temperatura riprende a crescere con un ritmo solitamente diverso da quello del solido, perché cambia il calore specifico (l'inclinazione del diagramma è diversa). L'aumento di temperatura non è indefinito: raggiunto un certo valore si ha un nuovo arresto. Durante questa fase avviene la vaporizzazione, cioè il passaggio da liquido ad aeriforme(2). Al termine della vaporizzazione (ricordiamo che il recipiente è ermeticamente chiuso, per cui il vapore di ferro è tutto nel pentolino) la temperatura riprende a crescere.
L'aumento è indefinito? Si, non ci sono altri passaggi di stato come i precedenti: il gas di ferro continua a ricevere calore e la sua temperatura cresce sempre. Quando essa raggiunge valori dell'ordine del milione di °C, inizia la trasformazione intima degli atomi: si ottiene il plasma.
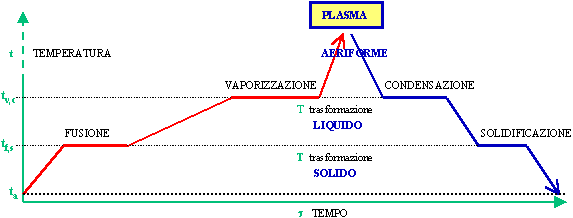
Se, invece di proseguire il riscaldamento sino allo stato di plasma, sottraiamo calore al gas di ferro (per esempio immergendo il pentolino in una vasca d'acqua), la temperatura diminuisce (diagramma blu) sino ad arrestarsi: avviene la condensazione, cioè il passaggio da aeriforme a liquido durante la quale viene restituito tutto il calore che era servito per la vaporizzazione.
Terminata la condensazione, la temperatura riprende a decrescere sino ad arrestarsi di nuovo: avviene la solidificazione, cioè il passaggio da liquido a solido, con la restituzione di tutto il calore adoperato per la fusione.
LEGGI DEI PASSAGGI DI STATO. Durante i passaggi di stato si osservano 4 leggi fondamentali (ci sono delle eccezioni, ma qui non le consideriamo): 1) la temperatura resta costante sin quando la trasformazione non è completa; 2) la pressione resta costante sin quando la trasformazione non è completa; 3) la trasformazione diretta avviene assorbendo una spesso notevole quantità di calore(3), detta calore latente di fusione o di vaporizzazione; 4) la trasformazione inversa avviene restituendo integralmente(4) il calore latente durante le fasi di condensazione e di solidificazione.
Le 4 leggi si spiegano ammettendo che le trasformazioni possono avvenire solo quando la distanza(5) fra gli atomi o fra le molecole ha superato (oppure è scesa al disotto) un certo valore caratteristico di ciascun materiale.
TECNOLOGIA DEI MATERIALI. Il diagramma TTT è alla base della tecnolgia dei materiali in quanto consente, con opportuni processi correttivi, di ottenere una grandissima quantità di variazioni dei materiali di base. Tre esempi:
1) tutti gli acciai hanno come componenti di fondo ferro e carbonio, ma lo studio dei diagrammi TTT consente oggi di avere migliaia di leghe, anche con altri elementi, adatte ai più svariati usi;
2) la distillazione frazionata del petrolio grezzo (detto semplicemente "greggio") si effettua in "torri di distillazione" nelle quali ad ogni "piano" regna una temperatura diversa, il che consente la vaporizzazione di una parte (frazione) del greggio, ricavando via via elementi sempre più "pesanti";
3) la distillazione frazionata dell'aria liquida per ottenere azoto e ossigeno.
PICCOLA NOMENCLATURA. La fusione si chiama fusione, e non liquefazione o scioglimento o squagliamento (il ghiaccio si è squagliato nella vodka!); la vaporizzazione si chiama vaporizzazione e non ebollizione o evaporazione; la condensazione si chiama condensazione e non liquefazione.
(1) Il ferro puro tecnicamente non esiste. Tutto ciò che comunemente viene detto ferro è in realtà acciaio, cioè la lega fra il ferro e il carbonio. La necessità di supporre di avere ferro puro deriva dal fatto che l'acciaio si comporta in modo assai diverso dal ferro.
(2) Talvolta manca completamente la fase liquida e il materiale passa direttamente da solido ad aeriforme: il processo è detto "sublimazione" ed è caratteristico ad esempio dello zolfo.
(3) Per portare un litro d'acqua da zero a cento °C occorrono circa 100 calorie: per vaporizzarlo (cioè trasformarlo interamente in vapore) occorrono circa 540 calorie. Questa differenza è una fortuna dal punto di vista biologico (noi siamo composti per circa il 65 % di acqua e quindi occorre una grande quantità di calore per farci bollire!) e una sfortuna dal punto di vista di molte applicazioni tecniche, come ad esempio nelle centrali termoelettriche, nelle quali si deve produrre vapore per muovere le turbine.
(4) Questo è uno dei pochissimi processi fisici nei quali il rendimento è uno, cioè senza perdite di energia. L'unico problema è che ben difficilmente noi siamo in grado di sfruttare il calore reso nella solidificazione o nella condensazione. Solo in poche installazioni ad esempio si utilizza il calore di condensazione delle centrali termoelettriche per il riscaldamento domestico in inverno (in Italia accade a Modena; più diffuso è nei paesi nordici, come Svezia e Finlandia).
(5) Nel caso della fusione si può dire: esiste una distanza dlim, detta "limite", tale che, se la distanza fra gli atomi è ds < dlim il materiale è solido; se la distanza è dl > dlim il materiale è liquido. Il calore latente di fusione serve per permettere agli atomi di effettuare il salto di distanza da ds a dl. Affinché accada occorre rompere tutti i legami che rendono il materiale solido (o liquido) e ciò è possibile solo spendendo energia. Viceversa accade durante le opposte fasi di solidificazione e di condensazione, nelle quali la ricostruzione dei legami interni si manifesta rendendo l'energia incamerata nella fase precedente. In sostanza nella fusione si trasforma energia sensibile (calore di fusione) in energia cinetica e il contrario nella fase di solidificazione (da energia cinetica in energia sensibile). Per le dimensioni degli atomi vedi il paragrafo "Energia solare" nel capitolo Elementi di meccanica celeste e astrofisica.