|
|
|
|
|
|
|
|
|
|
il gas produce o assorbe lavoro solo quando cambia volume
per ottenere questo scopo si adopera il calore come merce di scambio
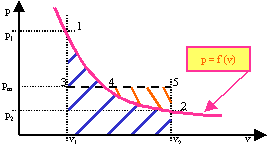
Il lavoro termodinamico si può calcolare usando le apposite leggi fisiche, oppure si può misurare in un diagramma costruito sul piano p, v (vedi figura). Il lavoro è rappresentato dall'area tratteggiata in blu ed è compresa fra il diagramma della trasformazione p = f ( v ) e l'asse delle ascisse, cioè l'area v1, 1, 2, v2.
Se supponiamo che l'area 3 - 1 - 4 sia uguale all'area 2 - 4 - 5 (tratteggiata in arancio), alla curva 1 - 4 - 2 possiamo sostituire il segmento orizzontale 3 - 4 - 5 (ordinata di compenso) e quindi possiamo dire che il lavoro è rappresentato dall'area v1, 3, 4, 5, v2. In questa situazione l'ordinata del segmento di compenso assume il significato di pressione media pm, e rappresenta quella pressione che, mantenendosi costante, consente di produrre lo stesso lavoro.
Schematicamente possiamo scrivere:
Dimostriamo che p D v rappresenta un lavoro (mentre non lo è v D p).
a) dal punto di vista dimensionale sia p D v sia v D p misuarano un lavoro meccanico; infatti:
b) dal punto di vista operativo. Ricordiamo che si chiama lavoro meccanico quello che deriva dal moto di un solido e quindi legato all'energia cinetica di un meccanismo solido. Se mettiamo un gas in un cilindro munito di pistone, si ha lavoro meccanico solo quando il pistone si muove per effetto appunto di una varizione di volume e non necessariamente di pressione. Quindi l'espressione del lavoro dovuto ad un gas è sempre del tipo p Dv, comunque sia la pressione (costante o variabile). Se usiamo la simbologia differenziale sarà sempre:
la quale rappresenta il lavoro meccanico elementare svolto o assorbito da un gas per effetto di una variazione elementare del suo volume. Se conosciamo le leggi di variazione di p e v, attraverso l'operazione integrale possiamo ricavare il lavoro svolto o assorbito lungo una qualunque trasformazione termodinamica (1, 2).
IL SEGNO DEL LAVORO E DEL CALORE.
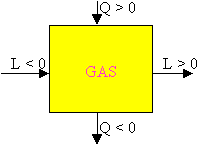
Se il lavoro si potesse identificare con la fatica, esso avrebbe sempre lo stesso segno (positivo o negativo). In termodinamica invece si distinguono due situazioni:
1) il lavoro prodotto dal gas che si espande da v1 a v2 > v1 viene detto positivo: L = p ( v2 - v1 );
2) il lavoro assorbito dal gas che si contrae da v1 a v2 < v1 viene detto negativo: L = p ( v2 - v1 ).
Questa convenzione è opposta a quella adottata per il calore, il quale viene detto positivo quando è assorbito dal gas, e negativo quando viene espulso. La convenzione è arbitraria e deriva semplicemente dagli scopi che noi vogliamo raggiungere: poiché il nostro scopo è di ottenere del lavoro meccanico quando forniamo calore al gas, ovviamente i segni sono quelli indicati.
A questo punto è bene ricordare l'esperienza di Joule, che dimostra l'equivalenza fra lavoro e calore.
 |
IL LAVORO NELLE TRASFORMAZIONI ELEMENTARI.
Alcune espressioni del lavoro si ricavano abbastanza facilmente, altre hanno bisogno del calcolo differenziale e integrale: per queste ultime daremo solo l'espressione finale.
1 ) isobara: essendo p1 = p2 = pm risulta subito (vedi la figura in alto) Lp = p ( v2 - v1 ) e sarà > 0 oppure < 0 a seconda che si tratti di una espansione o di una contrazione;
2 ) isoterma: essendo T costante l'equazione di stato diventa p v = R T = Z. L'espressione p v = Z rappresenta una iperbole equilatera (a seconda che Z sia positivo o negativo) della quale si considera solo il ramo nel primo quadrante.
Usando il calcolo integrale si ottiene LT = R T ln( v2 / v1 ) = R T ln( p1 / p2 ), nelle quali il simbolo ln significa "logaritmo naturale".
3 ) isocora: non essendoci variazione di volume risulta Lv = 0;
4 ) isoentropica o adiabatica: non esendoci scambio di calore e quindi essendo l'entropia costante(1), dalla definizione p vk = cost, si ricava Lk = R ( T1 - T2 ) / k - 1;
5 ) politropica: dalla definizione p va = cost si ricava La = R ( T1 - T2 ) / a - 1.
IL CALORE NELLE TRASFORMAZIONI ELEMENTARI.
Alcune espressioni del calore si ricavano abbastanza facilmente, altre hanno bisogno del calcolo differenziale e integrale: per queste ultime daremo solo l'espressione finale.
1 ) isobara: per effetto della definizione di calore specifico, risulta immediatamente Qp = cp DT;
2 ) isoterma: ricordando l'espressione dell'entalpia D I = D U + A D ( p v ) e che D U dipende solo dalla temperatura, essendo questa costante risulta D IT = A D ( p v ), cioè in pratica tutto lo scambio termico si trasforma in scambio di entalpia, cioè ancora in variazione di pressione e di volume. Dall'esperienza di Joule ricaviamo quindi che QT = A L = A R T ln p1 / p2;
3 ) isocora: per effetto della definizione di calore specifico, risulta immediatamente Qv = cv DT;
4 ) isoentropica o adiabatica: per definizione di adiabatico è Qk = 0;
5 ) politropica: lo scambio termico in una politropica (trasformazione intermedia fra l'isoterma e l'adiabatica), genera una variazione dell'energia interna D U e dell'energia esterna che chiamiamo lavoro L. Di conseguenza sarà Qa = D U + A L = cv DT + A R ( T1 - T2 ) / a - 1.
1) Per l'isoentropica risulta DS = 0; affinché ciò accada occorre che sia DQ = 0 e quindi l'isoentropica è anche adiabatica.