|
|
|
|
|
|
|
|
|
|
IL CALORE MISURA L'ENERGIA CINETICA, LA TEMPERATURA MISURA LA VELOCITA'.
Nello spazio intergalattico, nel vuoto quasi assoluto, viaggiano enormi nubi di gas di varia natura, mostrando talvolta temperature superiori al milione di °C. Al limite dell'atmosfera terrestre, nel quasi vuoto, si registrano temperature dell'ordine delle migliaia di °C. Come è possibile?
La risposta è nella teoria(1) cinetica dei gas (ma non solo!). L'assunto fondamentale è che l'energia in generale e il calore in particolare non è altro che "movimento di qualcosa". Le definizioni elementari di calore possono essere:
1) CALORE E TEMPERATURA NEI SOLIDI. Il calore è una misura(2) dell'ampiezza di oscillazione degli atomi. La temperatura è una misura della frequenza di oscillazione degli atomi. Gli atomi non sono fermi ma oscillano intorno ad una posizione media (dalla quale dipende ad esempio il volume) e quindi il loro moto è caratterizzato da due elementi, cioè ampiezza (da misurare in metri) e frequenza (da misurare in Hertz).
2) CALORE E TEMPERATURA NEI LIQUIDI. Il calore è una misura(2) della energia cinetica delle molecole(da misurare in Joule). La temperatura è una misura della velocità delle molecole (da misurare in metri al secondo). Ricordando l'espressione dell'energia cinetica (Ec = m v2 / 2 ) risulta ovvio che A) calore e temperatura sono legati dalla velocità v ma non sono la stessa cosa e B) il calore dipende dalla quantità e dalla qualità della massa m, per cui è possibile avere piccole masse (un ago arroventato con un fiammifero, piccola Ec) ad altissima temperatura (grande v), ma non in grado di far bollire una pentola d'acqua, e viceversa grandi masse (il mare) con enormi quantità di calore (grande Ec), ma a bassa temperatura (piccola v), anch'esse non in grado di far bollire una pentola d'acqua.
3) CALORE E TEMPERATURA NEGLI AERIFORMI. Il calore è una misura(2) della energia cinetica delle molecole (da misurare in Joule). La temperatura è una misura della velocità delle molecole (da misurare in metri al secondo). Se la distanza fra le molecole è grande (come accade nelle nubi intergalattiche o al limite della nostra atmosfera), la velocità può raggiungere valori elevatissimi, mostrando temperature comunque grandi, anche in assenza di calore, che dipende dall'energia cinetica e quindi dalla massa totale (la quale nel quasi vuoto è praticamente zero).
4) LA PRESSIONE NEGLI AERIFORMI. Tralasciando la pressione nei solidi (definizione elementare forza diviso superficie) e nei liquidi (p = g h, essendo(3) g il peso specifico e h l'affondamento), negli aeriformi la pressione è una misura dell'energia d'urto fra le molecole oppure fra di esse e le pareti del recipiente. Detto in questo modo parrebbe che la pressione si debba misurare in Joule, ma ciò non è vero (vedi nota 2). Per renderci conto della definizione, mettiamo del gas in un cilindro munito di pistone scorrevole: se il pistone non cade sul fondo del cilindro è perché le molecole del gas lo fanno "galleggiare" ad una certa quota urtandolo con continuità. Aumentando la temperatura l'energia d'urto aumenta e il pistone si muove liberando spazio per il gas.
5) LA DIFFUSIONE DEGLI AERIFORMI. Si dice comunemente che i gas tendono ad occupare(*) tutto lo spazio a loro disposizione. Ciò non è del tutto vero, ma qui ci occuperemo brevemente di quel che accade se ci sono due gas. Supponiamo allora che in un recipiente ci siano due gas A e B diversi, alla stessa pressione e alla stessa temperatura, ma separati da una parete (figura a sinistra). Se apriamo un piccolo buco i due gas iniziano a diffondere l'uno nell'altro molto lentamente.
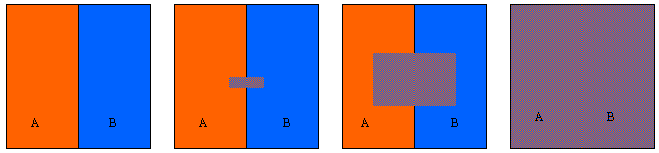
Se il foro è più grande la diffusione è più rapida e ben presto tutta la massa è una miscela dei due gas, come se la parete venisse tolta del tutto (figura a destra). L'unica differenza fra i tre casi è il tempo necessario alla completa miscelazione.
Ciò è una diretta conseguenza delle definizioni dello stato gassoso e della teoria cinetica. Solo statisticamente la temperatura e la pressione sono uguali nei due gas. In realtà ciascuna molecola, sia di A che di B, ha una sua temperatura, cioè ha una sua velocità diversa, in modulo, direzione e verso, da quella delle sue compagne. Ne segue che molecole di A penetrano attraverso il foro (poche per volta se il foro è piccolo, molte se il foro è grande) nella massa di B e viceversa, ma contemporaneamente, fanno le molecole di B in A.
Questa situazione può verificarsi con le bombole di gas liquido che si adoperano in casa. Se il recipiente si buca, il gas esce senza che si corra gran pericolo se c'è una finestra aperta: il gas si diluisce nell'atmosfera e si perde solo denaro. Diverso è se il gas satura l'ambiente entro un certo limite(4): nell'aria si trovano insieme combustibile dalla bombola e comburente (ossigeno) nell'aria: una fiamma o una scintilla provocano una esplosione.
Quando la bombola è "vuota", cioè il gas si è portato alla stessa pressione atmosferica, inizia la diffusione dell'aria nel recipiente, dove si può generare la miscela esplosiva: la fiamma può essere portata dentro la bombola dalla corrente aria - gas dovuta alla miscela che si forma in prossimità del foro e quindi produrre l'esplosione.
In definitiva non è possibile che due gas restino separati se non quando fra loro c'è una parete impermeabile. La miscelazione è inoltre facilitata, se c'è, da una anche minima differenza di massa specifica in conseguenza della sempre presente attrazione gravitazionale che tende a stratificare anche i gas a seconda del loro peso specifico(5).
Ammettiamo pure come vera la teoria cinetica dei gas: chiediamoci però perché, come, quando inizia il moto delle particelle componenti i corpi.
Per rispondere al "perché" bisogna avere fede in un Iniziatore delle cose e di conseguenza in uno "scopo finale" dell'esistenza dell'universo (vedi il paragrafo "Conclusione" nel capitolo Elementi di meccanica celeste e astrofisica). Al "come" e al "quando" è meno difficile rispondere, almeno in termini elementari.
L'universo è pieno di energia, in particolare di energia raggiante (o sottoforma di radiazione ad esempio elettromagnetica: vedi il capitolo La radiazione solare). Anche noi in casa "creiamo" tale radiazione quando accendiamo il fuoco o una lampada elettrica. Prendiamo un raggio luminoso (fotone) e con esso "colpiamo" un oggetto: l'energia del raggio (suddivisa(6) in "quanti") si trasmette agli elettroni dell'atomo colpito, il quale, per il gioco di forze di attrazione e di repulsione, si mette in moto o lo cambia. Il come quindi è questo, il quando possiamo addirittura deciderlo noi(7), accendendo o spegnendo una lampadina!
Immaginiamo di immergere un chiodo arroventato nel mare: molto probabilmente esso non si metterebbe tutto a bollire! Tuttavia almeno una molecola in più diventerebbe vapore. Questo discorsino ci porta a riflettere su due argomenti: la portata e la densità dell'energia. Diremo che la portata di energia è misurata dal numero di quanti forniti al corpo, mentre la densità è misurata dal loro numero nell'unità di tempo. E' chiaro che il chiodo arroventato ha si una grande densità di energia (tanto che emette luce!), ma la portata è piccola (il numero di atomi eccitati è veramente piccolo rispetto al mare!). Però per le prime molecole d'acqua incontrate dal chiodo, densità e portata sono sufficienti per produrre il loro cambiamento di stato da liquido ad aeriforme.
UNA ANALOGIA. E' esperienza di tutti che martellando un chiodo esso si riscalda: quali sono portata e densità di energia in questo caso? La portata è l'intensità dei colpi di martello (dipendente dalla massa e dalla velocità di caduta) e conduce al calore, mentre la densità è la frequenza dei colpi e conduce alla temperatura. E' evidente che dare un gran colpo ogni ora fa vibrare fortemente tutti gli atomi del chiodo (grande quantità di calore), ma non produce che modesti aumenti di temperatura. Viceversa frequentissimi colpi, anche se piccoli, producono ogni volta piccole forniture di calore, che però si sommano producendo aumenti notevoli di temperatura.
Ci si può legittimamente chiedere dove sono i fotoni, i quanti di energia, nel martello.
Ogni anno mi diverto con i miei alunni dicendo loro che non devono sentire dolore quando vengono presi a schiaffi dal padre, perché mai e poi mai e ancora mai la mano raggiungerà la guancia . Il ragionamento si fonda sul fatto che mai e poi mai e ancora mai potrà esserci un contatto fra gli atomi della mano e quelli della guancia (almeno con le consuete energie). Si è detto (vedi il paragrafo "Energia solare" nel capitolo Elementi di meccanica celeste e astrofisica) che gli atomi sono fatti di vuoto e che essi si presentano tutti verso l'esterno come campi elettrici negativi, fra i quali si esercita una forza di repulsione crescente man mano che diminuisce la distanza. Ne segue che durante l'azione di schiaffeggiamento o di martellamento, l'energia cinetica della massa in movimento si somma all'energia posseduta dagli atomi producendo una intensificazione dei campi elettromagnetici che circondano gli stessi atomi: i fotoni, i quanti, il dolore della guancia sono una conseguenza della variazione di tali campi, ma mai e poi mai e ancora mai potrà esserci un contatto fra gli atomi dei due oggetti (martello e chiodo oppure mano e guancia).
QUESTA NOTA E' RIPRESA DA ELEMENTI DI MECCANICA CELESTE E ASTROFISICA, PARAGRAFO MARTE:
(*) Comunemente si dice che i gas tendono ad occupare tutto lo spazio a loro disposizione. Ciò è vero per piccoli volumi chiusi di un solo gas. Se il volume è grande e il gas è una miscela, si ha una stratificazione secondo il peso specifico dei componenti. Nel caso delle atmosfere dei pianeti, la situazione è complicata dal gioco delle attrazioni gravitazionali: Mercurio è piccolo e vicino al sole: non ha atmosfera; Venere è grande e la sua atmosfera è quasi esclusivamente di CO2 che ha un peso specifico relativamente grande; Marte è relativamente grande, ma è vicino a Giove: la sua atmosfera è rarefatta e composta di elementi "pesanti"; ecc. ecc.
Anche l'atmosfera terrestre (con una potenza superiore a 700 km) è stratificata (il 90 % della sua massa si trova nei primi 20 km): vicino al suolo si trovano anidride carbonica, ossigeno, azoto (elementi pesanti); a 15.000 m di quota l'ossigeno è quasi assente. Oltre i 100 km c'è in pratica solo idrogeno, mentre l'elio (l'elemento più "leggero"), che pure viene continuamente prodotto per disintegrazione di rocce radioattive, non è presente che in tracce perchè viene disperso nello spazio.
Oltre i 90 km dal suolo della Terra, la densità è così piccola che le molecole di gas assumono una velocità altissima, come se la temperatura fosse di 1.500 °C. Questo fenomeno di temperatura "virtuale" è comune anche alle nubi interstellari e intergalattiche: la temperatura, misurata come velocità dei gas, può raggiungere i milioni di °C, ma la quantità di calore presente è praticamente zero poichè la densità del gas è anch'essa praticamente zero. La conseguenza è che un termometro immerso nella nube segnerebbe quasi 0 °K (-273 °C).
(1) Da molti decenni non è più una teoria ma un dato di fatto. Tuttavia si continua a chiamarla teoria.
(2) Attenzione: non è l'ampiezza o l'energia cinetica o la frequenza o la velocità, ma una quantità proporzionale ad esse; altrimenti ad esempio la temperatura si dovrebbe misurare in m / s o in Hz e il calore in m.
(3) Vedi il paragrafo "Strumenti di misura" nel capitolo Elementi di idraulica
(4) Si è portati a credere che qualunque quantità di gas combustibile in un certo ambiente possa produrre incendio oppure esplosione. Non è così. Affinché si abbia esplosione o incendio (sono entrambi combustioni, la prima molto veloce, il secondo lento) devono essere presenti combustibile e comburente in una fascia di concentrazione ben delimitata: il comburente da solo (l'ossigeno dell'aria o in bombole) non può bruciare e così pure il gas da solo (le bombole piene di gas). A seconda del tipo di gas esistono due valori di concentrazione (minimo e massimo) che consentono l'incendio; fuori di tali limiti, che corrispondono ad un eccesso di gas (poca aria) o ad un eccesso di aria (poco gas), la combustione non è possibile.
(5) Avendo fatto l'ipotesi che temperatura e pressione e volume sono uguali è lecito parlare di peso specifico.
(6) L'energia "viaggia" in pacchetti multipli di una unità chiamata "quanto di energia" non frazionabile, cioè gli atomi possono ricevere (o rendere) solo numeri interi di quanti.
(7) Non bisogna dimenticare che gli atomi si eccitano in modo relativamente facile, ma ancora più facilmente si diseccitano, cedendo l'energia ricevuta ad un atomo vicino oppure rimandandola all'esterno (assorbimento o riflessione dell'energia).