|
|
|
|
|
|
|
|
|
RAPPRESENTA LE CONDIZIONI p, v E t DURANTE LE TRASFORMAZIONI DI VAPORIZZAZIONE E DI CONDENSAZIONE.
Il diagramma si compone di 3 curve che individuano 4 regioni di esistenza.
Le 3 curve sono:
1) curva limite inferiore (c. l. i.): è costituita dai punti nei quali inizia la vaporizzazione (come A, 1, 1'); attenzione: la curva non può partire dall'origine perché non è possibile eseguire nessuna esperienza con volume e pressione nulli!
2) curva limite superiore (c. l. s.): è costituita dai punti nei quali termina la vaporizzazione (come B, 2, 2');
3) isoterma critica tc: è costituita dai punti nei quali avviene la trasformazione da vapore a gas (come C, 3, 3', Pc, 4).
Le tre curve hanno in comune il punto critico Pc, nel quale coesistono le condizioni di esistenza del liquido, del vapore saturo e del gas, per cui bastano piccole variazioni di pressione, volume o temperatura per passare istantaneamente dall'uno all'altro stato. Ciò accade ad esempio per il punto 4: se ci si muove a 300 atm, da sinistra a destra, il liquido diventa gas senza passare per la fase di vaporizzazione; viceversa, andando da destra a sinistra, il gas diventa liquido senza passare per la fase di condensazione.
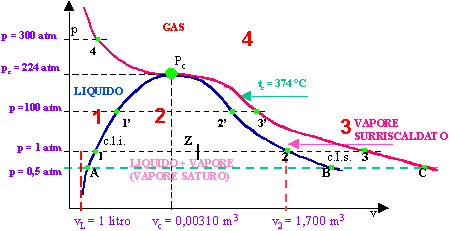
diagramma "curva a campana" dell'acqua, simile a quella di tutti i liquidi (non è in scala)
Le 4 regioni di esistenza sono:
1) il liquido, fra c. l. i. e tc: quando le coordinate p, v e t cadono in tale regione l'H2 O è allo stato liquido;
2) il vapore saturo, cioè la contemporanea presenza di vapore e liquido, fra c. l. i. e c. l. s.: quando le coordinate p, v e t cadono in tale regione l'H2 O è in fase di vaporizzazione se si va da sinistra a destra (ciò avviene fornendo calore), in fase di condensazione se si va da destra a sinistra (ciò avviene sottraendo calore); può pesentarsi in due forme: umido se contiene gocce d'acqua (come nebbia) oppure secco (vedi PICCOLO GLOSSARIO nel capitolo Generatori di vapore).
3) il vapore surriscaldato, cioè vapore a temperatura superiore a quella di vaporizzazione, fra c. l. s. e tc: continuando il riscaldamento l'H2 O passa allo stato di gas; raffreddando l'H2 O passa allo stato di vapore saturo;
4) il gas, cioè H2 O a temperatura superiore a 374 °C: il passaggio allo stato liquido può avvenire solo se la temperatura scende sotto tale valore.
LE ISOTERME.
Nelle regioni 1), 3) e 4) tendono ad essere parallele alla isoterma critica tc; nella regione 2) sono orizzontali e si sovrappongono alle isobare, poiché le trasformazioni di stato avvengono a temperatura e pressione costanti.
LE ISOBARE.
In tutte le regioni sono ovviamente orizzontali e nella regione 2) si sovrappongono alle isoterme, poiché le trasformazioni di stato avvengono a pressione e temperatura costanti.
IL PUNTO CRITICO.
Le coordinate del punto critico sono: tc = 374 °C; pc = 224 atm; vc = 0,00310 m3.
COSTRUZIONE DELLA CURVA A CAMPANA.
Procederemo a pressione costante quindi avremo un cilindro munito di pistone mobile con una scala per misurare i volumi e un termometro.
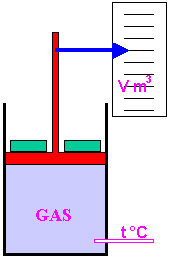
A) pressione atmosferica p = 1 atm. Nel cilindro poniamo 1 kg di acqua che corrisponde a v1 = 1 l = 0,001 m3; la temperatura sia t1 = 15 °C (nel diagramma siamo un poco a sinistra del punto 1). Riscaldiamo sino a portarci a 100 °C (siamo nel punto 1): inizia la vaporizzazione, la temperatura rimane costante, il volume cresce e il pistone si alza, siamo nella regione del vapore saturo. Dopo qualche tempo, sempre con la stessa pressione, continuando a fornire calore, la temperatura inizia a crescere: siamo nel punto 2, la vaporizzazione è terminata, il volume è diventato 1,700 m3 = 1.700 l. Dopo qualche tempo, sempre con la stessa pressione, continuando a fornire calore, la temperatura supera il valore di 374 °C: siamo nel punto 3, usciamo dalla regione del vapore surriscaldato ed entriamo nella regione del gas.
B) pressione 100 atm. Sul pistone poniamo un peso in modo che la pressione diventi 100 atm; la temperatura sia t1' = 15 °C (nel diagramma siamo un poco a sinistra del punto 1'). Riscaldiamo sino a portarci a 310 °C (siamo nel punto 1', il volume è un poco maggiore di 1 l): inizia la vaporizzazione, la temperatura rimane costante, il volume cresce e il pistone si alza, siamo nella regione del vapore saturo. Dopo qualche tempo, sempre con la stessa pressione, continuando a fornire calore, la temperatura inizia a crescere: siamo nel punto 2', la vaporizzazione è terminata, il volume è diventato 0,01815 m3 = 18,15 l. Dopo qualche tempo, sempre con la stessa pressione, continuando a fornire calore, la temperatura supera il valore di 374 °C: siamo nel punto 3', usciamo dalla regione del vapore surriscaldato ed entriamo nella regione del gas.
C) pressione 0,5 atm. Invece di mettere pesi sul pistone, lo tiriamo verso l'alto in modo che la pressione diventi 0,5 atm; la temperatura sia come prima tA = 15 °C (nel diagramma siamo un poco a sinistra del punto A). Riscaldiamo sino a portarci a 80 °C (siamo nel punto A, il volume è un poco maggiore di 1 l): inizia la vaporizzazione, la temperatura rimane costante, il volume cresce e il pistone si alza, siamo nella regione del vapore saturo. Dopo qualche tempo, sempre con la stessa pressione, continuando a fornire calore, la temperatura inizia a crescere: siamo nel punto B, la vaporizzazione è terminata, il volume è diventato 3,304 m3 = 3.304 l. Dopo qualche tempo, sempre con la stessa pressione, continuando a fornire calore, la temperatura supera il valore di 374 °C: siamo nel punto C, usciamo dalla regione del vapore surriscaldato ed entriamo nella regione del gas.
PERCORRENDO LE ISOBARE ALL'INVERSO DA DESTRA VERSO SINISTRA.
D) il punto Z. Si ammette che in tutti i punti intermedi, come Z, fra c. l. i. e c. l. s. la proporzione fra liquido già vaporizzato e liquido residuo sia rappresentato dai segmenti 1-Z e Z-2 secondo la relazione x = Pv / Pl = 1-Z / 1-2, nella quale Pv è il peso del vapore e Pl è il peso di liquido iniziale, che nel nostro caso è 1 kg. Il numero "x" prende il nome di titolo del vapore.
IL CALORE.
Il calore latente di vaporizzazione (che verrà restituito durante la condensazione) è: QA,B = 550,6 Cal; Q1,2 = 539,9 Cal; Q1',2' = 311,8 Cal; generalmente viene indicato con il simbolo "r". Per i punti intermedi come Z, vale la stessa proporzione come per il titolo x. Nel punto critico il calore di vaporizzazione è ovviamente zero.
IL DIAGRAMMA DI MOLLIER.
Il diagramma di Mollier discende direttamente dalla curva a campana cambiando le coordinate: da (p, v) a (I, S), cioè da pressione - volume specifico a entalpia - entropia.