6c. Risultati.
In assenza di antiossidante la produzione di dieni coniugati indotti da AAPH nei liposomi di fosfatidilcolina di soja procedeva a velocità costante e Rp era 15.2 M-8 s-1. La velocità di iniziazione misurata dal periodo di inibizione causato da a -tocoferolo 5 m M era 0.52 M-8 s-1, e la lunghezza della catena cinetica, (kinetic chain length, kcl), calcolata dal rapporto Rp/Ri, era 29.2.
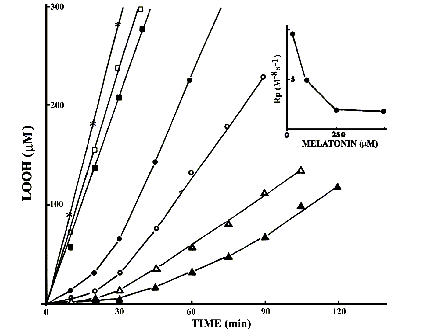
Quantità crescenti di melatonina da 5 a 500 m M venivano utilizzate per valutare la soppressione dose-dipendente della perossidazione lipidica (Fig. 12).

Fig. 12
Inibizione della lipoperossidazione, indotta da AAPH in liposomi di fosfatidilcolina di soja, da parte di varie concentrazioni di melatonina. (*), melatonina assente; ( ), 5 mM; (n ), 10 mM; (· ), 30 m M; (o ), 100 m M; (D ), 250 m M; (s ), 500 m M. Inserto: Relazione tra la velocità di propagazione e le concentrazioni di melatonina.Le quantità di melatonina necessarie a provocare inibizioni di un certo rilievo apparivano piuttosto elevate. Concentrazioni di melatonina 5 e 10 m M non provocavano nessun periodo di inibizione, sebbene riducessero leggermente la velocità di produzione degli idroperossidi (Fig. 12).
Brevi periodi d’inibizione erano osservati a concentrazioni di melatonina variabili da 30 a 500 m M, sebbene la durata del periodo di inibizione non era proporzionale alla concentrazione di antiossidante. Tuttavia, concentrazioni di melatonina fra 30 e 500 m M accorciavano la lunghezza della catena cinetica durante la fase di propagazione. La velocità di propagazione dopo il periodo di inibizione era notevolmente più bassa che in assenza di antiossidante, diminuiva in maniera dose-dipendente, ma non era correlata linearmente alla concentrazione di antiossidante (Fig. 12, inserto).
La melatonina è una molecola sia idrofila che lipofila, quindi può interagire con radicali formati sia in fase acquosa che nella fase lipidica.
Per capire se l’inibizione al processo di perossidazione fosse dovuta ad interazione della melatonina con il radicale iniziatore o ad una azione chain-breaking per interazione con il radicale lipoperossilico, sono stati fatti altri saggi utilizzando liposomi di dimiristoilcolina, un lipide saturo non perossidabile, in presenza di AAPH. La cinetica del consumo della melatonina, messo in evidenza come perdita di fluorescenza, in questi liposomi è stata confrontata con quella che si aveva nei liposomi di fosfatidilcolina di soja. La reazione di melatonina 30 mM con i radicali di AAPH, indicata dal suo consumo quando è inserita nei liposomi di dimiristoilcolina, avviene secondo cinetiche lineari, che riflettono la dissociazione termica dell’AAPH, costante nel tempo (Fig. 13). In tali condizioni la melatonina veniva consumata ad una velocità pari a 0.058
M-8s-1 (Fig. 13). In presenza di fosfatidilcolina di soja la cinetica del consumo di melatonina non è lineare e la velocità di scomparsa è maggiore. Una velocità di consumo, calcolata come 0.19 M-8s-1 dalla curva che descrive il decremento molare, era misurata in 15 min., cioè il tempo di inibizione provocato da melatonina 30 mM (Fig. 13). Quindi la velocità di scomparsa della melatonina rallentava, fino a raggiungere quella misurata nei liposomi di DMC. I risultati indicano che oltre a reagire con il radicale iniziatore la molecola di melatonina è in grado di reagire direttamente anche con i radicali dei lipidi.
La curva differenziale (Fig. 13) può rappresentare con buona approssimazione la velocità con la quale la melatonina reagisce con i lipoperossiradicali. Questa analisi rivelava che la melatonina veniva consumata a velocità pari a 0.13 M-8s-1 durante il periodo di inibizione. A titolo di confronto, la velocità di scomparsa di a-tocoferolo, incorporato in liposomi nelle stesse condizioni sperimentali, era valutata 0.17 M-8s-1 .

Fig. 13.
Consumo di melatonina 30 mM durante il processo di perossidazione indotto da AAPH 2 mM in liposomi di dimiristoilcolina (curva A) o di fosfatidilcolina di soja (curva B). I valori sono corretti per la perdita di fluorescenza di melatonina 30 mM, incorporata in liposomi, in assenza di AAPH. La curva C rappresenta la curva differenziale.Il tocoferolo è il più importante antiossidante chain-breaking in sistemi lipidici. Nelle condizioni valutate nella nostra sperimentazione, la melatonina era un antiossidante assai meno efficace del tocoferolo, sulla base dose/effetto. Tuttavia noi abbiamo valutato l’effetto antiossidante di una combinazione di melatonina e tocoferolo, entrambi 5 mM, sulla perossidazione di liposomi di fosfatidilcolina di soia, comparando il risultato a quelli ottenuti con i singoli composti (Fig. 14). Poiché la melatonina era inefficace da sola (Tinh = 0), i dati danno chiara evidenza di una attività antiossidante sinergica (Fig. 14).
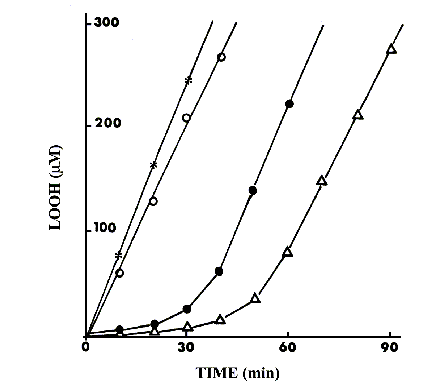
Fig. 14.
Inibizione della ossidazione di liposomi di fosfatidilcolina di soja (*) da parte di melatonina 5 mM (o ), a -tocoferolo 5 mM (l ), o loro combinazione (D ). La perossidazione era indotta da AAPH 2 mM a 37°C, in aria.