I TENSIOATTIVI
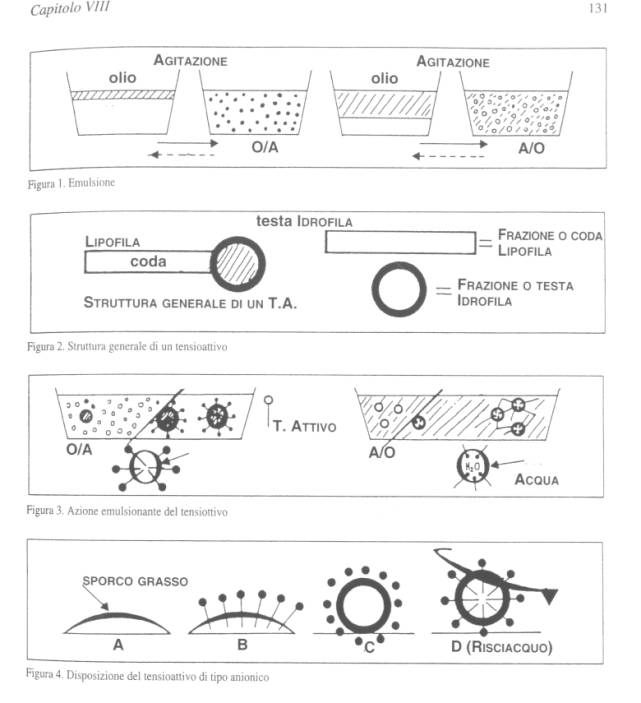
I tensioattivi, detti anche tensidi o surfactanti, sono tra le materie prime più importanti nella composizione di un cosmetico. Infatti si trovano nei latti detergenti, nei saponi, negli shampoo, nelle creme, nei balsami, nei disinfettanti non alcolici e in molti altri prodotti. La loro principale azione è quella di abbassare in modo energico due forze fisiche: la tensione superficiale e la tensione interfacciale. Questa proprietà permette un più intimo contatto tra sostanze non miscibili con l'acqua (per esempio oli, grassi e particelle di polvere), favorendo in tal modo i processi di emulsionamento e di detersione. In base alla loro struttura chimica, i tensioattivi svolgono le seguenti azioni: emulsionante detergente schiumogena bagnante-umidificante filmogena-sostantivante disinfettante solubilizzante. Ciò spiega l'utilizzo non di uno, ma di miscele di tensioattivi: in uno shampoo cremoso, per esempio, potremo avere tensioattivi detergenti, schiumogeni ed emulsionanti. Spiegare il loro meccanismo d'azione significa comprendere come avvengono le più importanti azioni cosmetiche. TENSIONE SUPERFICIALE - TENSIONE INTERFACCIALE Bisogna innanzi tutto precisare che sulla superficie di ogni liquido esiste una tensione dovuta alle forze attrattive che le molecole poste all'interno del liquido esercitano su quelle superficiali e periferiche, tanto da sollecitare il liquido stesso ad assumere la minore superficie possibile, come se fosse avvolto in una membrana elastica tesa; questa forza di superficie viene chiamata tensione superficiale. Se invece versiamo un liquido in un altro nel quale non è miscelatale (per esempio l'acqua nell'olio), la suddetta tensione impedisce agli stessi di mescolarsi; in questo caso si parla di tensione interfacciale. Mettendo dunque a contatto acqua e olio, non si potrà avere una dispersione spontanea, ma se agitiamo energicamente il sistema, in modo da vincere la tensione interfacciale, si otterrà un'emulsione in cui un liquido è finemente disperso nell'altro sotto forma di minuscole gocce. Terminata l'agitazione, però, si osserverà, in un tempo più o meno lungo, che le piccole gocce disperse tendono a ingrandirsi sino ad arrivare alla netta separazione delle due fasi. In questo caso l'utilizzo di un tensioattivo emulsionante è in grado di stabilizzare l'emulsione. PRINCIPALI AZIONI DEI TENSIOATTIVI I tensioattivi agiscono, dunque, abbassando la tensione superficiale e interfacciale e rendendo possibili le seguenti azioni: disperdere omogeneamente e stabilizzare le due fasi (acqua e olio: A e O): azione emulsionante; solubilizzare le sostanze grasse e allontanarle da una superficie: azione detergente; formare schiuma attraverso la diminuzione della tensione superficiale tra un liquido e un gas (per esempio acqua e aria); azione schiumogena; far penetrare una soluzione nei minimi anfratti del mantello cutaneo; azione bagnante; fissarsi sui tessuti (capacità peculiare dei tensidi cationici) svolgendo azione filmogena e ammorbidente; azione sostantivante; solubilizzare i lipidi della membrana dei batteri (caricati negativamente), distruggendoli; anche quest'azione è una caratteristica proprietà di alcuni tensioattivi cationici: azione battericida e batteriostatica; solubilizzare nell'acqua corpi grassi come olio di ricino, vitamine liposolubili, olì essenziali e profumi; azione solubilizzante. MECCANISMO D'AZIONE1) Azione emulsionante. Le emulsioni possono essere di tipo olio in acqua (O/A o O/W in inglese), oppure acqua in olio (A/O). II liquido presente in quantità minore si disperde nell'altro, formando delle goccioline, e costituisce la cosiddetta fase "dispersa" o "discontinua", mentre la sostanza presente in quantità maggiore costituisce la fase "disperdente" o "continua". Per evitare la separazione delle due fasi interviene il tensioattivo che, essendo costituito da una parte idrofila chiamata "testa" e una parte lipofila chiamata "coda", svolge un'azione di stabilizzazione nei confronti dell'emulsione (vedi figura). Infatti la testa è solubile in acqua e nelle soluzioni acquose, mentre la coda è solubile nei liquidi oleosi e nei grassi. Il tensioattivo emulsionante si dispone con le teste e con le code rivolte verso le rispettive fasi: in tal modo consente la mescolanza dei due liquidi, abbassandone la tensione interfacciale. Questa duplice affinità ha dato origine all'importante nozione dell'HLB, abbreviazione che sta per hydrophilic lipophilic balance (equilibrio lipofilo idrofilo). L'HLB è una scala convenzionale, da 0 a 20, che consente di scegliere l'emulsionante più adatto per ottenere un determinato tipo di emulsione. Gli emulsionanti ad HLB basso sono preferibilmente lipofili, quindi trascinano in dispersione le goccioline d'acqua formando emulsioni A/O. Con HLB alto l'emulsionante sarà idrofilo e trascinerà le gocce di olio in acqua, originando emulsioni O/A. 2) Azione detergente. L'acqua non è in grado di asportare il sudiciume grasso da una superficie; il tensioattivo, in particolare quello di tipo anionico (si veda la classificazione), si dispone come da figura. A poco a poco lo strato di grasso si stacca e viene completamente rivestito dalle teste idrofile del tensioattivo. A questo punto lo strato di grasso diventa solubile in acqua e quindi facilmente asportabile con il risciacquo acquoso o con l'uso di un tonico. La fondamentale differenza tra un tenside detergente e uno emulsionante consiste nella grande capacità del gruppo idrofilo del tensioattivo anionico (che assume carica negativa in soluzione acquosa) di staccare lo sporco (carico positivamente) da un substrato (per esempio dalla pelle). 3) Azione schiumogena. La schiuma è dovuta all'agente tensioattivo presente nel prodotto che forma un'emulsione di aria in acqua; è quindi un sistema disperso costituito da bolle di gas in un liquido. La schiuma aiuta a disperdere le particelle di sporco, ne facilita l'asportazione e ne evita la riprecipitazione sulla superficie lavata. Il potere schiumogeno è direttamente proporzionale all'azione del tensioattivo del prodotto utilizzato.Per esempio: tanto più un sapone produce schiuma, tanto maggiore sarà la sua azione sulla tensione superficiale e, di conseguenza, tanto più marcato il suo potere sgrassante sulla pelle.Considerato il fatto che la schiuma è più un'esigenza di marketing che la vuole sempre abbinata all'idea di pulito, possiamo affermare che un buon detergente non deve necessariamente produrre schiuma, anzi, come si è visto, più schiuma significa maggiore aggressione detergente. I mezzi detergenti attualmente usati, in particolare i tensioattivi denominati "alchilsolfati", spesso non si limitano ad asportare lo sporco. Eliminano anche i lipidi presenti sulla superficie cutanea (sebo, NMF) e talvolta giungono a intaccare il "cemento" lipidico intercellulare dello strato corneo. Perciò quando si parla di prodotti detergenti e del fatto che possano procurare secchezza e desquamazioni, è necessario ricordare che il vero responsabile risulta essere il tensioattivo, più che un pH non perfettamente fisiologico. E’ che il cosmetologo, il consumatore e il dispensatore di cosmetici devono saper valutare e preferire quei detergenti in grado di non depauperare eccessivamente il mantello idroacido-lipidico della cute. 4) Azione bagnante. Quest'azione si manifesta con la penetrazione della soluzione nei minimi anfratti del mantello cutaneo, resa possibile dalla caduta della tensione superficiale. Tale proprietà consente, per esempio, di bagnare sporco e substrato; nel caso dei detergenti cutanei il substrato è lo strato cheratinico. Oppure nella fabbricazione di alcuni prodotti quali fondo tinta e rossetti è necessario che i pigmenti impiegati debbano essere perfettamente "umettati" per rendere il cosmetico omogeneo e funzionale. 5) Azioni fìlmogene e sostantivanti. Queste attività sono proprie dei tensidi cationici.La parte positiva di queste molecole si fissa sulle superfici elettricamente negative (spesso tali dopo una detersione), formando uno strato protettivo e ammorbidente sui tessuti. Se un tensioattivo con tali funzioni viene aggiunto nella fase del risciacquo, esso produce la sensazione del soffice.Vengono anche usati nei preparati per l'acconciatura del capello grazie alle proprietà ammorbidenti e condizionanti contro il cosiddetto fenomeno del fly away. ovvero quella caratteristica elettrostatica che si verifica dopo lo shampoo. L'azione in questo caso è antistatica. 6) Azione solubilizzante. Le attuali esigenze di mercato chiedono ai cosmetici prestazioni e proprietà speciali, come per esempio solubilizzare nell'acqua sostanze comunemente idrofobe quali la lanolina, le vitamine liposolubili, oli essenziali, alcuni coloranti, ecc. Generalmente si utilizzano tensioattivi del tipo "non ionico". Il termine "poliossietilenato", a volte presente nella formulazione di un prodotto, sta a indicare che una molecola è stata modificata nella sua struttura e viene appunto fissata con ossido di etilene. Tali prodotti, da considerarsi semi sintetici, diventano dispersibili nell'acqua o totalmente solubili. SUDDIVISIONE ELETTROCHIMICA DEI TENSIDIA seconda che la parte attiva della molecola sia carica elettronegativamente, elettropositivamente, con entrambe le cariche o senza carica elettrica, si distinguono i tensioattivi in: Anionici - Cationici + Anfoteri - + Non ionici Anionici - La parte attiva della loro molecola ha carica elettrica negativa. I rappresentanti più importanti del gruppo sono i saponi, gli alcoli grassi sulfonati e prodotti affini. Hanno elevate qualità detersive, schiumogene ed emulsionanti. Cationici - La parte attiva della molecola ha carica positiva. Sono generalmente derivati quaternari di ammonio, piridinio o chinolinio. Non adatti come detersivi, sono dotati di sostantività per i tessuti su cui tendono a fissarsi con un effetto ammorbidente. Quasi tutti hanno un grandissimo potere antisettico. Sono incompatibili coi tensidi anionici, inattivandosi a vicenda. Anfoteri - Hanno nella molecola una carica positiva e una negativa. Uniscono spesso proprietà degli anionici a quelle batteriostatiche dei cationici. Sono chiamati così perché si comportano da anionici se il pH dell'ambiente è alcalino (>7) e da cationici se è acido (pH<7). In genere sono detergenti delicati e ben tollerati. Non ionici - Sono sprovvisti di carica elettrica. Nell'acqua la loro molecola non si dissocia non dividendosi in ioni, il che conferisce loro una maggior compatibilita con gli altri ingredienti. TENSIOATTIVI NATURALIIn natura esistono sostanze tensioattive denominate saponine in quanto, miscelate con acqua, generano schiuma.Sono ben note le saponine della Saponaria e della Quillaia (legno di panama). Un'altra sostanza naturale con proprietà tensioattive è la lecitina.
|