La Classificazione FAB
La classificazione FAB ha rappresentato un primo fondamentale contributo alla
identificazione di 5 sottogruppi con caratteristiche individuali (Tab 4).
Essa è basata principalmente su criteri morfologici evidenziabili all'aspirato midollare
ed allo striscio periferico.
Parametro fondamentale della classificazione è la determinazione della percentuale di
blasti nel midollo e nel periferico. A differenza della LMA i blasti della SMD presentano
un discreto grado di variabilità tant'è che già nel 1982 venivano considerati due
tipologie di blasti (tipo I e II);successivamente si è sentita l'esigenza di
introdurre un nuovo tipo di blasto (tipo III) e
recentemente è stato anche proposto un ulteriore tipo di blasto (tipo IV). (Tab. 5) (17,18).
La monocitosi periferica, la presenza di corpi di Auer e la percentuale dei sideroblasti
ad anello costituiscono criteri classificativi aggiuntivi.
I sideroblasti ad anello (tipo III) sono degli eritroblasti che presentano numerosi
granuli disposti a corona concentrica intorno al nucleo. Essi rivestono una importanza
fondamentale per l'identificazione delle forme ASIA caratterizzate per
definizione da una percentuale di sideroblasti uguale o superiore al 15% delle cellule
midollari.
Le forme identificate dalla classificazione FAB non sono entità completamente separate ed
è frequente osservare nello stesso paziente l'evoluzione da forme a blastosi minima a
forme con eccesso di blasti.
Alle differenze morfologiche tra le varie forme corrispondono diversità biologiche,
cliniche e prognostiche.
Caratteristiche Cliniche
Anemia refrattaria (AR)
- Anemia isolata normo-macrocitica, a volte associata a piastrinosi
- Midollo in genere ipercellulato con iperplasia eritroide e diseritropoiesi
- Scarse anomalie della serie granuloblastica e megacariocitica
- Blasti midollari inferiori al 5%, assenza di blasti circolanti
- Sideroblasti ad anello inferiori al 15%
- Evoluzione leucemica nel 20% dei casi.
- Evoluzione in ipo-aplasia midollare nel 30-40% dei casi
- Sopravvivenza media 3-4 anni
|
|
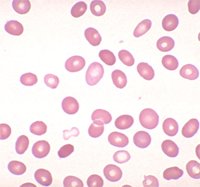
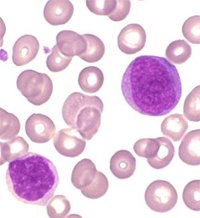
Fig.1 -
Anemia refrattaria. A sinistra anomalie degli eritrociti; a destra aspetto tipico del
midollo |
 |
 |
|
|
Anemia refrattaria con sideroblasti ad anello (ASIA)
- Come AR ma con sideroblasti ad anello >15%
- Decorso clinico benigno con sopravvivenza mediana sui 10anni
- Evoluzione leucemica nel 10% dei casi
|

|
Fig. 2 - ASIA - Midollo,
colorazione di Perls, con tipici sideroblasti ad anello |
|
Anemia refrattaria con eccesso di blasti (AREB)
- Anemia normo-macrocitica associata a leuco-piastrinopenia
- Midollo ipercellulare con displasia trilineare
- Blasti midollari tra il 5 ed il 20%, e non oltre il 5% di blasti periferici
- Frequenti anomalie citogenetiche
- Sopravvivenza mediana 12-20 mesi
- La buona parte evolve in LA mentre gli altri pazienti decedono per complicanze
emorragiche infettive e malattie intercorrenti
|
Anemia refrattaria con eccesso di blasti in
trasformazione (AREBt)
- Come AREB ma con almeno:
- >5% blasti circolanti e con 20 - 30% di blasti midollari
|
| Fig. 3 - AREBt - A sinistra
blasti nel periferico; a destra aspetto del midollo |
 |
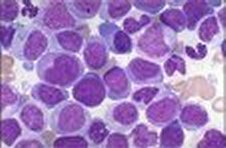 |
|
|
|
|
Leucemia mielomonocitica cronica (LMMoC)
- Monocitosi assoluta (>1000 x 109/L)
- Anemia associata a piastrinopenia, leucocitosi
- Elevati livelli serici ed urinari di lisozima
- Frequente epatosplenomegalia
- Midollo con iperplasia mieloide e frequente riscontro di elementi paramieloidi e
monocitoidi, blasti midollari tra il 5-20% con presenza di monoblasti.
- Sopravvivenza mediana 12-24 mesi
- Rischi di evoluzione leucemica come per RAEB
|
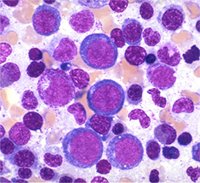
 Fig.
4 - L. mielomonocitica cronica, midollo Fig.
4 - L. mielomonocitica cronica, midollo |
|
Varianti clinico-citologiche
peculiari
Negli ultimi anni sono stati individuati alcuni quadri di SMD con caratteristiche
peculiari:
- SMD Ipoplasiche. Rappresentano il 7-19% delle forme
mielodisplatiche e sono caratterizzate da una cellularità midollare alla diagnosi tra il
20-30% in pazienti con età oltre i 60 anni (5).
L'identificazione degli aspetti mielodisplastici può essere difficoltosa quando la
cellularità midollare è bassa, e la biopsia ossea resta indagine di fondamentale
importanza per la diagnosi differenziale in particolare depongono per una forma
mielodisplastica la presenza di ALIP (abnormal localization of immature precursor
/aggregati o cluster di precursori immaturi in sede anomala centrolacunare), di isolotti
eritroidi e il riscontro di diseritro-megacariocitopoiesi (19,20,21).
Importante ai fini prognostici-terapeutici la diagnosi differenziale con l'anemia
aplastica.
- La SMD associata a mielofibrosi. Nelle SMD è frequente il
riscontro di una modesta fibrosi midollare, tuttavia in una modesta percentuale di casi
essa invece è rilevante.
Questi casi sul piano clinico sono caratterizzati da pancitopenia, minima organomegalia,
quadro midollare con displasia trilineare con megacariociti atipici (micromegacariociti),
discreta quota di blasti con quadro periferico leucoeritroblastico con possibile riscontro
di micromegacariociti circolanti (22,23). La diagnosi differenziale va posta con le sindromi
mieloproliferative in fase acuta ed in particolare con la varietà M7.
- "Syndrome of abnormal chromatin clumping
in leukocytes". Nuova entità di recente segnalazione caratterizzata da aspetti
mieloproliferativi e mielodisplastici e con anomalie della cromatina dei granulociti
neutrofili. Il quadro clinico è caratterizzato da complicanze emorragiche ed infettive
pur in presenza di bassa quota di blasti midollari (24).
- SMD con eosinofilia. Eosinofilia oltre il 5% può essere
riscontrata in corso di AREB e AREBt. Gli
eosinofili presentano granulazioni abnormi. Non è ancora noto se questa quota eosinofila
è di tipo reattivo oppure clone patologico autonomo (25).
- SMD con monocitosi. La presenza di una monocitosi periferica
superiore al 10%, pur non soddisfacendo i criteri per la diagnosi di LMMoC ,identifica un subset di pazienti che presentano una elevata
probabilità di evoluzione in mielodisplasia ad alto rischio (LMMoC, AREB, AREBt) e/o in leucemia acuta con componente
monocitica (M4,M5 FAB)(26).
Quadri clinici borderline
In alcuni casi le SMD possono essere caratterizzate inizialmente da alterazioni
ematologiche sfumate non facilmente distinguibili da altre patologie: macrocitosi isolata,
neutropenia cronica idiopatica trombocitopenia, monocitosi.
In questi casi una sorveglianza nel tempo con controlli seriati permetterà una diagnosi
di SMD.
|
|
| Tab. 4-La
classificazione F.A.B |
 |
AR |
ASIA |
AREB |
AREBt |
LMMoC |
Anemia |
presente |
presente |
presente |
presente |
presente |
Monocitosi (>1x10/9/l) |
no |
no |
no |
no |
si |
Blasti periferici |
<1% |
<1% |
<5% |
>5% |
5% |
Blasti midollari |
<5% |
<5% |
5-20% |
20-30% |
<20% |
Sideroblasti ad anello |
<15% |
>15% |
indifferente |
indifferente |
indifferente |
Corpi di Auer nei blasti |
assenti |
assenti |
assenti |
presenti |
assenti |
|
|
| Tab. 5-Caratteristiche
morfologiche dei blasti nelle SMD |
Tipo blasto |
Caratteristiche |
| Blasto I |
poche granulazioni citoplasmatiche, nucleoli prominenti, cromatina
lassa e rapporto N/C elevato |
| Blasto II |
diverse granulazioni citoplasmatiche(fino a 20),nucleo in posizione
centrale, rapporto N/C più basso |
| Blasto III |
numerose granulazioni (>20),assenza di nucleo eccentrico
rapporto n/c elevato, assenza apparato di Golgi |
| Blasto IV |
non granulazioni, presenza apparato di Golgi nucleo rotondeggiante
moderatamente indentato |
|
|
|

|
|
|
 Fig.
4 - L. mielomonocitica cronica, midollo
Fig.
4 - L. mielomonocitica cronica, midollo