|
|
|
|
|
|
|
|
|
|
IL CALORE E IL LAVORO SONO LA STESSA COSA.
L'esperienza di Joule è stata ed è di fondamentale importanza nello studio della termodinamica per almeno due motivi: 1) permette di stabilire l'equivalenza fra lavoro e calore in termini fisici e 2) permette di stabilire l'equivalenza fra lavoro e calore in termini di unità di misura.
Sino alla metà del 1.700 il calore fu un oggetto misterioso della fisica (si chiamava fluido calorico) e, addirittura, se ne cercava il peso. Era ancora considerato, insieme a terra, acqua e aria, con il nome di fuoco, uno degli elementi costituenti la materia, così come aveva stabilito Aristotele 300 anni a. C. Ma ancora oggi è certamente utile, accostandosi alla termodinamica, individuare gli elementi di unitarietà confluenti da diversi "mondi" fisici apparentemente separati. In effetti il mondo della meccanica e quello della termodinamica possono sembrare lontani, legati debolmente dal fatto che l'attrito "crea calore" e che con il calore si "crea lavoro". L'esperienza di Joule consente di mostrare che calore e lavoro hanno un'unica anima: IL MOVIMENTO.
L'esperienza può essere raccontata ed effettuata in molti modi; io la eseguirò nel modo forse più semplice e intuitivo.
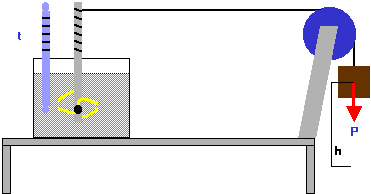
DISPOSITIVO SPERIMENTALE.
a) un recipiente perfettamente isolato termicamente(1);
b) un litro di acqua distillata alla temperatura iniziale di 15,5 °C;
c) un termometro;
d) un asse rotante munito di agitatore nella parte immersa nell'acqua (vedi figura);
e) una funicella avvolta a spirale sulla parte emersa dell'asse e passante nella gola di una carrucola all'altra estremità;
f) un peso P di 427 kg legato alla seconda estremità della funicella;
g) un barometro che segna la pressione di 1 atm.
CONDUZIONE DELL'ESPERIMENTO.
Si lascia cadere liberamente il peso P per un'altezza h di un metro. La funicella si svolge dall'asse facendolo ruotare e l'agitatore comunica il suo moto all'acqua. Il termometro segnala un aumento di temperatura da 15,5 °C a 16,5 °C. In queste condizioni il lavoro è L = 427 x 1 = 427 [ kg m ] e, di conseguenza, l'acqua ha ricevuto la quantità di calore Q = 1 [ Cal ].
RISULTATI SPERIMENTALI.
Se noi ripetessimo l'esperienza di Joule a casa otterremmo questo risultato? Assolutamente no! Vediamo perché:
a) il recipiente non è isolato e parte del calore esce all'esterno;
b) il vetro del termometro, l'asse e l'agitatore assorbono calore;
c) una parte in più dell'acqua evapora per effetto dell'aumento di temperatura;
d) la funicella, la carrucola e il suo asse assorbono lavoro per attrito;
e) l'aria ostacola la discesa del peso;
f) .....
Se però conoscessimo quanto calore e quanto lavoro si perde per effetto di tutte le cause elencate .... Bene, è proprio questo che è stato fatto in centinaia di laboratori, in migliaia di ripetizioni dell'esperimento di Joule, e il risultato riportato al paragrafo precedente è una certezza sperimentale. Il numero 427 (che si usa nelle applicazioni) è corretto alla seconda cifra decimale e quindi rappresenta un ottimo risultato tecnico.
Si è visto che, per effetto dell' agitazione, la temperatura dell'acqua cresce. Perché allora, agitando il caffellatte con un cucchiaino, esso si raffredda?
Il motivo è semplice: l'agitazione produce due effetti: a) accelera l'uscita del vapore dalla massa del liquido e b) fa entrare aria fresca all'interno della massa agitata. Il risultato è che il calore in uscita è di più di quello prodotto con il cucchiaino.
Il moto del peso è "ordinato", quello dell'acqua è "disordinato"(2). Questo fatto ci induce a parlare di trasformazioni di energia reversibili e irreversibili. Diremo che una trasformazione di energia è reversibile quando è possibile (anche solo teoricamente) farla avvenire nel verso opposto; diremo che è irreversibile quando ciò non è possibile(3).
In generale le trasformazioni che interessano il calore sono irreversibili. Nel caso in esame, se l'acqua raffreddandosi di un grado Celsius facesse girare l'asse al contrario, riportando il peso nella posizione iniziale, se ciò potesse accadere, la trasformazione di lavoro in calore sarebbe reversibile. Questo accadrebbe se il moto delle molecole d'acqua fosse ordinato: basterebbe, anche solo teoricamente(4), invertire il senso del moto e il peso P tornerebbe in alto!
Riesaminando i risultati sperimentali, si possono trarre alcune conclusioni di importanza capitale per la termodinamica:
A) è possibile trasformare integralmente il lavoro in calore e quindi porre l'equivalenza Q = A L, nella quale A(5) rappresenta il fattore di conversione (nel sistema pratico) del lavoro in calore e quindi A = 1 / 427 per cui risulta 1 [ Cal ] = 427 [ kg m ] = 4.186 [ J ];
B) è impossibile trasformare integralmente il calore in lavoro e quindi la trasformazione lavoro ---> calore è irreversibile, essendo il calore una energia disordinata.
tratto da "http://www.geocities.com/Athens/Acropolis/6914/ind.htm"
(1) E' questa la condizione più difficile da realizzare; infatti non esistono materiali perfettamente impermeabili al calore, ma soltanto materiali, detti isolanti, i quali possono ritardare la trasmissione del calore.
(2) E' questo un punto molto importante della termodinamica in quanto ha implicazioni nel significato di entropia. Qui il significato di ordine e disordine è nel senso che i solidi in movimento mostrano delle particelle elementari (atomo e molecole) che percorrono tutte insieme una certa traiettoria mentre nel liquido ciascuna molecola può avere ed ha una traiettoria dipendente dalle traiettorie delle altre molecole, ma non strettamente legata a quelle.
(3) Una definizione di reversibile si ricava dalla definizione di "ciclo termodinamico" che è la situazione nella quale il gas, dopo aver subito una serie di trasformazioni (cambiamenti di pressione, di volume, di temperatura) ritorna esattamente allo stato iniziale (come avviene percorrendo un cerchio, chiclos in greco) per poter eseguire ancora le stesse trasformazioni.
(4) Questa ipotesi non può essere fatta neppure in senso teorico perché è assolutamente da escludere un moto retrogrado e ordinato delle molecole del liquido. D'altra parte, se il calore è una funzione (una misura) dell'energia cinetica delle molecole, anche il "tornare indietro" è un movimento e quindi calore, cioè se le molecole di liquido si muovessero all'incontrario ciò corrisponderebbe alla produzione di altro calore e quindi ad un ulteriore aumento di temperatura.
(5) Nel sistema internazionale si scrive semplicemente Q = L poiché l'unità di misura è la stessa, cioè il Joule.